tính nồng độ phần trăm của dung dịch tạo thành khi hòa tan 7,8 gam kali kim loại vào 36,2 gam nước ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nK = \(\dfrac{39}{39}\) = 1 (mol)
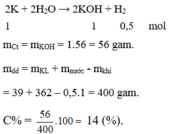
PTHH: 2K + 2H2O→ 2KOH + H2
nH2 =\(\dfrac{1}{2}\).nK = 0,5 mol; nKOH = nK = 1 mol;
mdung dịch = mK + mH2O – mH2
=39 + 362 – 0,5.2
= 400 (gam)
C%KOH=\(\dfrac{m_{KOH}}{mddsau}\).100%C%KOH= \(1,\dfrac{56}{400}\).100%= 14%.
Chọn C
PTHH: 2K + 2H2O→ 2KOH + H2
nH2 =1212.nK = 0,5 mol; nKOH = nK = 1 mol;
mdung dịch = mK + mH2O – mH2
=39 + 362 – 0,5.2
= 400 (gam)
C%KOH=mKOHmddsau.100%C%KOH=mKOHmddsau.100% = 1.56400.100%1.56400.100% = 14%.
B

\(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
_____0,4----------------->0,4----->0,2
=> mNaOH = 0,4.40 = 16(g)
mdd = 9,2 + 50 - 0,2.2 = 58,8(g)
=> \(C\%=\dfrac{16}{58,8}.100\%=27,21\%\)
=> D

Đáp án B
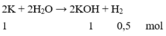
m C t = m K O H = 1.56 = 56 gam.
m d d = m K L + m n ư ớ c - m k h í = 39 + 362 – 0,5.1 = 400 gam.
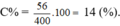

Đáp án C.
K + H2O → KOH +  H2
H2
Số mol K: nK = 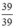 = 1(mol)
= 1(mol)
Số mol KOH: nKOH = nK = 1(mol)
Khối lượng KOH là mKOH = 56.1 = 56 (g)
Số mol H2: nH2 = 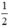 nK= 0,5(mol)
nK= 0,5(mol)
Khối lượng dung dịch là mdd = 39 + 362 – 0,5.2 = 400 (g)
Nồng độ C%KOH = 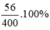 = 14%
= 14%

a)
\(C\%_{dd.KOH}=\dfrac{7,5}{7,5+42,5}.100\%=15\%\)
b) \(n_{HNO_3}=\dfrac{1,26}{63}=0,02\left(mol\right)\Rightarrow C_{M\left(dd.HNO_3\right)}=\dfrac{0,02}{0,016}=1,25M\)

a, \(C\%_{KCl}=\dfrac{20}{20+60}.100\%=25\%\)
b, \(C\%=\dfrac{40}{40+150}.100\%\approx21,05\%\)
c, \(C\%_{NaOH}=\dfrac{60}{60+240}.100\%=20\%\)
d, \(C\%_{NaNO_3}=\dfrac{30}{30+90}.100\%=25\%\)
e, \(m_{NaCl}=150.60\%=90\left(g\right)\)
f, \(m_{ddA}=\dfrac{25}{10\%}=250\left(g\right)\)
g, \(n_{NaOH}=120.20\%=24\left(g\right)\)
Gọi: nNaOH (thêm vào) = a (g)
\(\Rightarrow\dfrac{a+24}{a+120}.100\%=25\%\Rightarrow a=8\left(g\right)\)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ n_{Al}=x(mol);n_{Mg}=y(mol)\\ \Rightarrow 27x+24y=7,8(1)\\ a,2Al+6HCl\to 2AlCl_3+3H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow 1,5x+y=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\\ \Rightarrow \%_{Mg}=100\%-69,23\%=30,77\%\)
\(b,\Sigma n_{HCl}=3x+2y=0,8(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,8.36,5}{192,2}.100\%=15,19\%\\ c,n_{AlCl_3}=0,2(mol);n_{MgCl_2}=0,1(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{0,2.27+192,2-0,3.2}.100\%=13,55\%\\ C\%_{MgCl_2}=\dfrac{0,1.95}{0,1.24+192,2-0,1.2}.100\%=4,89\%\)
2K + 2 H2O -> 2 KOH + H2
0,2____0,2___0,2____0,1(mol)
nK= 7,8/39=0,2(mol) => nKOH= 0,2(mol) => mKOH= 0,2.56=11,2(g)
mddsau= mK + mH2O - mH2= 7,8+36,2-0,1.2=43,8(g)
=> C%ddKOH= \(\frac{11,2}{43,8}.100\approx25,571\%\)