Cho m gam hỗn hợp Cu, Al tác dụng vừa đủ với dung dịch axit sunfuric 20% (loãng) thì thu được 6,72l khí H2 (đktc), dung dịch A và 10g chất rắn không tan.
a) Viết PTPỨ, tính m.
b) Tính khối lượng dung dịch axit sunfuric cần dùng.
c) Cho 47,95g kim loại Bari vào dung dịch A khi phản ứng kết thúc thu được dung dịch B. Tính nồng độ phần trăm chất tan trong dung dịch B.

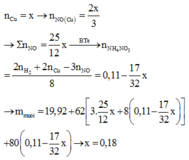
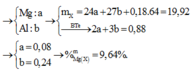
a) 2Al (0,2) + 3H2SO4 (0,3) -----> Al2(SO4)3 + 3H2 (0,3)
b) - nH2 = 0,3 mol
- Theo PTHH: nAl = 0,2 mol
=> mAl = 5,4 gam
=> mCu = 4,6 gam
==>mhh=5,4+4,6=10 g
b Theo PTHH: nH2SO4 = 0,3 mol
=> mH2SO4 = 29,4 gam
=> mdd H2SO4 = 29,4.100\20=147gam
\(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\left(1\right)\)
0,2______0,3_____________0,1________0,3
\(n_{H_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
a) => \(m=0,2.27+10=15,4\left(g\right)\)
b) \(m_{d^2H_2SO_4}=\frac{0,3.98.100}{20}=147\left(g\right)\)
c) \(Ba+2H_2O-->Ba\left(OH\right)_2+H_2\left(2\right)\)
0.35__________________0,35
\(n_{Ba}=\frac{47,95}{137}=0,35\left(mol\right)\)
\(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3-->3BaSO_4\downarrow+2Al\left(OH\right)_3\downarrow\)
0,3___________0,1_______________0,3 _______0,2
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2-->Ba\left(AlO_2\right)_2+4H_2O\left(3\right)\)
0,1__________0,05__________0,05
\(m_{d^2sau}=0,2.27+147-0,3.2+47,95-0,3.233-0,2.78=137,55\left(g\right)\)
\(C\%_{Ba\left(AlO_2\right)_2}=\frac{0,05.255}{137,55}.100=9,27\%\)