A là một hiđrocacbon tồn tại ở thể khí trong điều kiện thường. Đốt cháy hoàn toàn 0.4gam A bằng khí oxi dư, rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào 2750 ml dung dịch Ca(OH)2 0,01 M, phản ứng xong thu được 2,5 gam kết tủa. Xác định công thức phân tử của A.
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

24 tháng 2 2019
Đáp án D
Ta có mCO2 + mH2O + mdd Ba(OH)2 = mkết tủa + mddsau phản ứng
mCO2 + mH2O = mkết tủa + mddsau phản ứng – mdd Ba(OH)2= 39,4 – 19,912 = 19,488g
Gọi x = nCO2, y = nH2O
44x + 18y = 19,488 và 12x + 2y = 4,64
x = 0,348 và y = 0,232
nCO2 : nH2O = 0,348 : 0,232
Hay nC : nH = 0,348 : 0,464 = 3 : 4 Hiđrocacbon là C3H4

3 tháng 1 2017
Ta có mCO2 + mH2O + mdd Ba(OH)2 = mkết tủa + mddsau phản ứng
mCO2 + mH2O = mkết tủa + mddsau phản ứng – mdd Ba(OH)2= 39,4 – 19,912 = 19,488g
Gọi x = nCO2, y = nH2O 44x + 18y = 19,488 và 12x + 2y = 4,64
x = 0,348 và y = 0,232 nCO2 : nH2O = 0,348 : 0,232
Hay nC : nH = 0,348 : 0,464 = 3 : 4 =>Hiđrocacbon là C3H4
=> Chọn D.
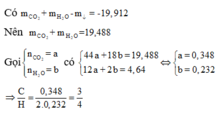
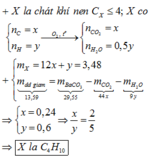
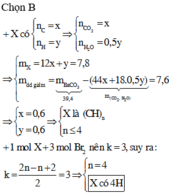
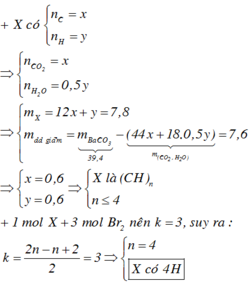

A + O2\(\rightarrow\) CO2 + H2O
Sản phẩm cháy gồm CO2 và H2O
Dẫn sản phẩm cháy vào 0,0275 mol Ca(OH)2 thu được kết tủa là CaCO3
\(\rightarrow\)nCaCO3=\(\frac{2}{100}\)=0,02 mol
TH1: Sản phẩm chỉ có CaCO3
\(\rightarrow\)nCO2=nCaCO3=0,025 mol.
\(\rightarrow\)0,4 gam A chứa 0,025 mol C\(\rightarrow\)mH=0,1\(\rightarrow\) nH=0,1
\(\rightarrow\)C:H=1:4 \(\rightarrow\) (CH4)n vì số H không quá 2 C+2\(\rightarrow\) CH4
TH2: Sản phẩm gồm 0,025 mol CaCO3 và Ca(HCO3)2 0,0025 mol (bảo toàn Ca)
\(\rightarrow\) nCO2=nCaCO3 +2nCa(HCO3)2=0,03 mol
\(\rightarrow\) A chứa 0,03 mol C\(\rightarrow\) mH=0,04\(\rightarrow\) nH=0,04
\(\rightarrow\)nC:nH=3:4 \(\rightarrow\) (C3H4)n vì là khí nên là C3H4
bạn ơi tại sao 0,4 gam A chứa 0,025 mol C thì mH = 0,1 vậy