Cho m(g) hỗn hợp Na và Fe tác dụng hết với axit HCl . Dung dịch thu được cho tác dụng với Ba(OH)2 dư rồi lọc lấy kết tủa tách ra , nung nóng trong không khí đến khối lượng không đổi thu được chất rắn nặng m gam . Tính % khối lượng mỗi kim loại ban đầu
Các bạn giải gấp cho mk bài này nha . Mk đang cần rất gấp bạn nào giải đúng mk tick cho




Gọi nFe = b (mol)
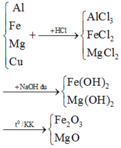
Fe +2HCl → FeCl2 + H2
2Na + 2HCl → 2NaCl + H2
FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2
Nung nóng trong không khí: 4Fe(OH)2 + O2 → 2Fe2O3 + H2O
=> nFe = nFeCl2 = nFe(OH)2 = b => nFe2O3 = \(\frac{1}{2}\)nFe(OH)2 = \(\frac{b}{2}\)(mol)
=> mFe2O3 = \(\frac{b}{2}\).160 = 80b (gam)
mà mFe2O3=m (đề bài) => 80b = m => 56b = \(\frac{56m}{80}=0,7m\)
=> mFe = 0,7m
=>%mFe = \(\frac{0,7m}{m}\cdot100\%=70\%\)
=> %mNa = 30%
* Nhắc nhở nho nhỏ nè : Mấy bài như thế này bạn phân tích từng câu từng chữ sẽ dễ hơn đó ^-^
- Dung dịch thu được gồm NaCl , FeCl2 và HCl có thể dư
-Cho tác dụng Ba(OH)2 dư lọc lấy kết tủa => Fe(OH)2
Nung nóng trong không khí có phản ứng :
=>chất rắn thu được chỉ có Fe2O3
=> Bảo toàn Fe => nFe(hỗn hợp đầu )=\(\frac{m}{160}.2=\frac{m}{80}\)
=> mFe(hỗn hợp đầu )=( m/80 ).56=0.7m
=>mNa = m-0.7m=0.3m
%Fe=70%
%Na=30%