Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Fe_3O_4}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow56x+232y=3,44\left(1\right)\)
Chất rắn thu được sau khi nung là Fe2O3.
\(\Rightarrow n_{Fe_2O_3}=\dfrac{4}{160}=0,025\left(mol\right)\)
BTNT Fe, có: \(n_{Fe}+3n_{Fe_3O_4}=2n_{Fe_2O_3}\)
\(\Rightarrow x+3y=0,05\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,01\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,02.56=1,12\left(g\right)\\m_{Fe_3O_4}=2,32\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Cu Ag Fe Al → O 2 , t 0 Y → HCldu A → NaOH kt → t 0 Z
– Tác dụng với oxi dư
2Cu + O2 →2CuO
4Fe + 3O2→2Fe2O3
4Al + 3O2 →2Al2O3
– Tác dụng với HCl dư
CuO +2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
– Tác dụng với NaOH dư
NaOH + HCl → NaCl + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
AlCl3 + 3NaOH → 2H2O + 3NaCl + NaAlO2
– Nung trong không khí
2Fe(OH)3 →Fe2O3 + 3H2O
Cu(OH)2→CuO + H2O
=> Z gồm CuO và Fe2O3

D chứa 2 oxide: \(MgO,Fe_2O_3\) (oxide 2 kim loại có tính khử cao nhất)
Vậy hỗn hợp A dư, muối đồng(II) hết.
B gồm Cu, Fe
\(Mg+CuSO_4->MgSO_4+Cu\\ Fe+CuSO_4->MgSO_4+Cu\\ MgSO_4+2NaOH->Mg\left(OH\right)_2+Na_2SO_4\\FeSO_4+2NaOH->Fe\left(OH\right)_2+Na_2SO_4 \\ Mg\left(OH\right)_2-^{^{t^{^0}}}->MgO+H_2O\\2 Fe\left(OH\right)_2+\dfrac{1}{2}O_2-^{^{ }t^{^{ }0}}->Fe_2O_3+2H_2O\\ n_{Mg}=a;n_{Fe\left(pư\right)}=b\\ \Delta m\uparrow=9,2-6,8=40a+8b=2,4\left(I\right)\\ 40a+\dfrac{160b}{2}=6\left(II\right)\\ \Rightarrow a=b=0,05mol\\ m_B=9,2=64\left(a+b\right)+56n_{Fe\left(dư\right)}\\ n_{Fe\left(dư\right)}=0,05\left(mol\right)\\ \%m_{Mg}=\dfrac{24.0,05}{6,8}.100\%=17,65\%\\ \%m_{Fe}=82,35\%\)
Bước 1: Viết các phương trình phản ứng
Phản ứng 1: Mg + CuSO4 -> MgSO4 + Cu
Phản ứng 2: Fe + CuSO4 -> FeSO4 + Cu
Phản ứng 3: Cu(OH)2 -> CuO + H2O
Bước 2: Tính toán số mol của chất rắn B
Khối lượng chất rắn B = 9,2g
Khối lượng mol CuSO4 = 63.55g/mol + 32.07g/mol + (4 * 16g/mol) = 159.62g/mol
Số mol CuSO4 = 9,2g / 159.62g/mol = 0.0577 mol
Vì phản ứng 1 và phản ứng 2 xảy ra hoàn toàn, nên số mol Mg và Fe trong hỗn hợp A cần tìm là 0.0577 mol.
Bước 3: Tính toán % số mol mỗi kim loại trong A
Khối lượng mol Mg = 24.31g/mol
Khối lượng mol Fe = 55.85g/mol
% số mol Mg trong A = (0.0577 mol * 24.31g/mol) / 6.8g * 100% = 20.34%
% số mol Fe trong A = (0.0577 mol * 55.85g/mol) / 6.8g * 100% = 47.28%
Vậy, % số mol mỗi kim loại trong hỗn hợp A là: Mg: 20.34% và Fe: 47.28%.





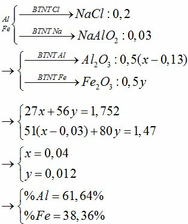
Gọi nFe = b (mol)
Fe +2HCl → FeCl2 + H2
2Na + 2HCl → 2NaCl + H2
FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2
Nung nóng trong không khí: 4Fe(OH)2 + O2 → 2Fe2O3 + H2O
=> nFe = nFeCl2 = nFe(OH)2 = b => nFe2O3 = \(\frac{1}{2}\)nFe(OH)2 = \(\frac{b}{2}\)(mol)
=> mFe2O3 = \(\frac{b}{2}\).160 = 80b (gam)
mà mFe2O3=m (đề bài) => 80b = m => 56b = \(\frac{56m}{80}=0,7m\)
=> mFe = 0,7m
=>%mFe = \(\frac{0,7m}{m}\cdot100\%=70\%\)
=> %mNa = 30%
* Nhắc nhở nho nhỏ nè : Mấy bài như thế này bạn phân tích từng câu từng chữ sẽ dễ hơn đó ^-^
- Dung dịch thu được gồm NaCl , FeCl2 và HCl có thể dư
-Cho tác dụng Ba(OH)2 dư lọc lấy kết tủa => Fe(OH)2
Nung nóng trong không khí có phản ứng :
=>chất rắn thu được chỉ có Fe2O3
=> Bảo toàn Fe => nFe(hỗn hợp đầu )=\(\frac{m}{160}.2=\frac{m}{80}\)
=> mFe(hỗn hợp đầu )=( m/80 ).56=0.7m
=>mNa = m-0.7m=0.3m
%Fe=70%
%Na=30%