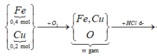
Đốt cháy hoàn toàn 4,48l H2 trong 3,36l O2 . Ngưng tụ s.phẩm thu được chất lỏng A và khí B. Cho toàn bộ khí B phản ứng hết vs 5,6g Fe thu được hỗn hợp chất rắn C. Hòa tan ss số mol dư, hết toàn bộ chất rắn C vào dung dịch D và khí E. Xác định các chất có trong A,B,C,D,E. Tính khối lượng mỗi chất có trong A,C và số mol các chất có trong dung dịch D:
Biết: 3Fe+2O2=>Fe3O4
Fe+2HCl=>FeCl2+H2
Fe3O4+8HCl=>FeCl2+2FeCl3 + 4H2O


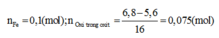
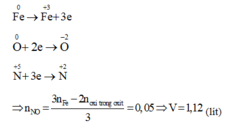
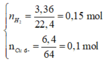
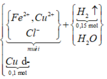



Bạn xem lại đề giúp mk nhé
Phương trình phản ứng đốt cháy H2 trong ôxi:
![[IMG]](http://www.codecogs.com/eq.latex?2H_2+O_2%20%5Crightarrow%20%202H_2O)
![[IMG]](http://www.codecogs.com/eq.latex?So%20%5C%20mol%20%5C%5C%20n_%7BH_2%7D=%5Cfrac%7B4,48%7D%7B22,4%7D=0,2%20%28mol%29%5C%5Cn_%7BO_2%7D=%5Cfrac%7B3,36%7D%7B22,4%7D=0,15%20%28mol%29%5C%5C%5CRightarrow%20Oxi%20%5C%20du;%20%5C%20n_%7BO_2du%7D=0,05%28mol%29)
![[IMG]](http://www.codecogs.com/eq.latex?3Fe+2O_2%5Crightarrow%20Fe_3O_4) (2)[/FONT]
(2)[/FONT]
![[IMG]](http://www.codecogs.com/eq.latex?n_%7BFe%7D=%5Cfrac%7B5,6%7D%7B56%7D=0,1%20%28mol%29)
![[IMG]](http://www.codecogs.com/eq.latex?Fe%20%20%20%20+%20%202HCl%20%20%20%20%5Crightarrow%20%20%20%20FeCl_2%20%20+%20H_2%20%20%20%20%20%20%20%20%20%20%20%20%20%20%20%283%29%5C%5C%20%20%20Fe_3O_4%20%20+%20%208HCl%20%20%5Crightarrow%20%20%20%20%20FeCl_2%20+%202FeCl_3%20+%204H2O%20%20%20%20%20%284%29)
![[IMG]](http://www.codecogs.com/eq.latex?n_%7BHCl%7D=%5Cfrac%7B14,6%7D%7B36,5%7D=0,4%20%28mol%29%5C%5Ctheo%20%5C%20%283%29%284%29%20%5C%20n_%7BHCl%20%5C%20tham%20%5C%20gia%20%5C%20pu%7D=2.0,025+8.0,025=0,25%28mol%29%5C%5C%20%20HCl_%7Bdu%7D=%200,4%20%E2%80%93%200,25%20=%200,15%20%28mol%29.)
![[IMG]](http://www.codecogs.com/eq.latex?%5CRightarrow%20n_%7BFeCl_2%7D=0,05%28mol%29%5C%5C%5CRightarrow%20%20n_%7BFeCl_3%7D=0,05%28mol%5C%5C%5CRightarrow%20n_%7BHCl%29=0,15%28mol)
Vậy ngưng tụ sản phẩm: chất lỏng A là H2O có khối lượng: 0,2.18 = 3,6 (g);Khí B là oxi
khi cho B phản ứng với Fe:
Từ kết quả trên: O2 tham gia phản ứng (2) là 0,05mol.Nên Fe cần cho phản ứng (2) là: 0,075mol. => Chất rắn C gồm: 0,025 mol Fe3O4 và (0,1 - 0,075) = 0,025mol Fe dư và có khối lượng: 0,025. 232 + 0,025. 56 = 7,2 (g)+ Cho toàn bộ chất rắn C vào dd HCl :