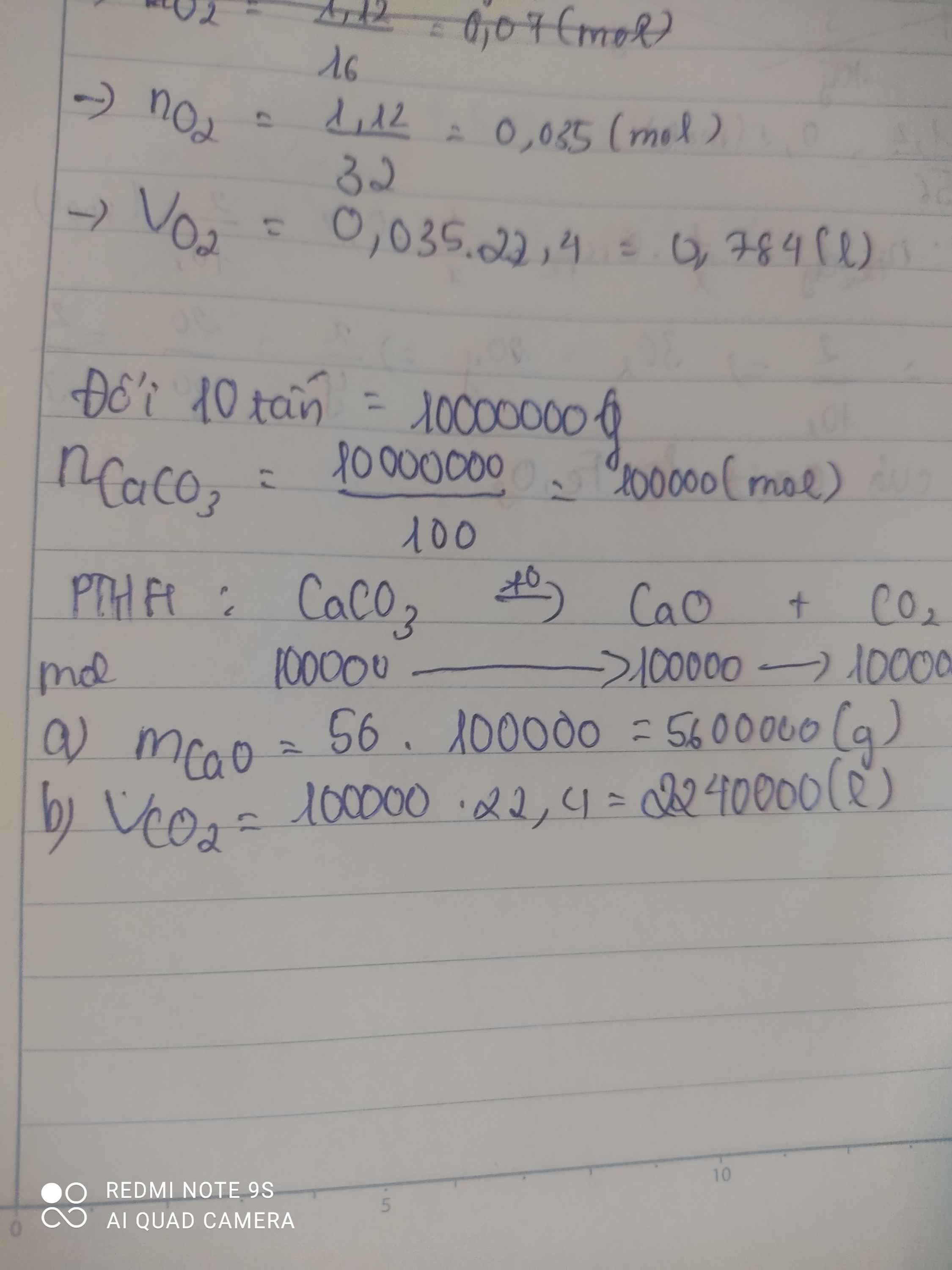Nung 5kg đá vôi có chứa 80% canxi cacbonat CaCO3 thu được canxi oxit CaO(vôi sống)và khí cacbon đioxit.Hãy tính khối lượng vôi sống thu được nếu hiệu suất phản ứng là 85%?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH : \(CaCO_3\left(t^o\right)->CaO+CO_2\uparrow\) (1)
10 tấn -> 10 000 000 g
\(n_{CaCO_3}=\dfrac{m}{M}=\dfrac{10000000}{40+12+16.3}=\text{100000}\left(mol\right)\)
Từ (1) => \(n_{CaCO_3}=n_{CaO}=\text{100000}mol\)
=> \(m_{CaO}=n.M=100000.56=5600000\left(g\right)\)
b) Từ (1) => \(n_{CaCO_3}=n_{CO_2}=\text{100000}mol\)
=> \(V_{CO_2\left(đktc\right)}=n.22,4=100000.22,4=2240000\left(l\right)\)

tham khảo
a, Giả sử đem nung 100g đá vôi :
trong đó mCaCO3=100.85%=85(g )
m tạp chất=100-85=15(g )
khối lượng CO2 =100-70%.100=30(g )
PTHH: CaCO3----->CaO + CO2
100g------>56g---->44g
x-------> y-------->30g
m=Khối lượng CaCO3 bị nung là: mCaCO3= (30. 56 )/ 44= 68,2g
=>H%CaCO3 =68,2/ 85. 100%= 80,2%
b, Khối lượng CaO tạo thành là: mCaO= (30. 56)/ 44= 38.2(g)
Thành phần %CaO trong chất rắn sau khi nung là: m%CaO=38,2/70.100%=54.6%

a) CaCO3 --to--> CaO + CO2 (1)
n\(CaCO_3\) = \(\dfrac{10000000}{100}\) = 100000(mol)
Theo PT (1) ta có: nCaO = n\(CaCO_3\) = 100000(mol)
=> mCaO = 100000.56 = 5600000(g) = 5,6(tấn)
b) Theo PT (1) ta có: n\(CO_2\) = n\(CaCO_3\) = 100000(mol)
=> V\(CO_2\) = 100000.22,4 = 2240000(l)

a) CaCO3 --to--> CaO + CO2
Theo ĐLBTKL: mCaCO3 = mCaO + mCO2 (1)
b) (1) => mCaCO3 = 150 + 120 = 270 (kg)
=> \(\%CaCO_3=\dfrac{270}{300}.100\%=90\%\)
a, PTHH:
\(CaCO_3\underrightarrow{t^o}2CaO+CO_2\)
\(mCaCO_3=mCaO+mCO_2\)
b,\(mCaCO_3=mCaO+mCO_2=150+120=270kg\)
\(\Rightarrow\%CaCO_3=\dfrac{270}{300}.100=90\%\)
vậy...

Đáp án D
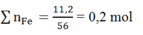
Khi ngâm m gam vào dung dịch Cu(NO3)2 thì chỉ có Fe phản ứng:
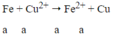
Δm = 64a - 56a = 8a → nFe = 0,4/8 = 0,05 mol
Fe3O4 → 3Fe
b 3b
Ta có: 0,05 + 2b = 0,2 → b = 0,05 mol
m = 0,05.56 + 0,05.232 = 14,4g

a) $n_{H_2SO_4} = \dfrac{44,1}{98} = 0,45(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{Al} = \dfrac{2}{3}n_{H_2SO_4} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
b) $n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$\Rightarrow V_{H_2} = 0,45.22,4 =1 0,08(lít)$
c)
Cách 1 : $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,15(mol)$
$\Rightarrow m_{Al_2(SO_4)_3} = 0,15.342 = 51,3(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{Al_2(SO_4)_3} = 8,1 + 44,1 - 0,45.2 = 51,3(gam)$