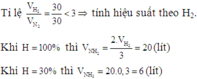Cho 30 lít N2, 30 lít H2 trong điều kiện thích hợp sẽ tạo ra thể tích NH3 (ở cùng điều kiện) khi hiệu suất phản ứng đạt 30% là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


N2+3H2---->2NH3
Tie lệ
\(\frac{30}{1}>\frac{30}{3}\)--->N2 dư..tính theo H2
Theo pthh2
n NH3=2/3n H2
-->VNH3=2/3V H2=\(\frac{30.2}{3}=20\left(l\right)\)
Do H%=40%
-->V NH3=\(\frac{20.40}{100}=9\left(l\right)\)

\(M_A=5.2=10\left(g/mol\right)\)
Do các khí đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích cũng là tỉ lệ mol
Chọn \(\left\{{}\begin{matrix}n_{H_2}=17,5\left(mol\right)\\n_{N_2}=5\left(mol\right)\end{matrix}\right.\)
Gọi \(n_{N_2\left(p\text{ư}\right)}=a\left(mol\right)\left(0< a< 5\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
a---->3a---------->2a
Xét tỉ lệ: \(5< \dfrac{17,5}{3}\Rightarrow\) Hiệu suất phản ứng tính theo N2
Ta có: \(n_A=5+17,5+2a-a-3a=22,5-2a\left(mol\right)\)
Theo ĐLBTKL: \(m_A=5.28+17,5.2=175\left(g\right)\)
\(\Rightarrow M_A=\dfrac{175}{22,5-2a}=10\Leftrightarrow a=2,5\left(TM\right)\)
\(\Rightarrow H=\dfrac{2,5}{5}.100\%=50\%\)

H=50%H=50%
Giải thích các bước giải:
3N2+H2t∘,p,xt−−−→2NH33N2+H2→t∘,p,xt2NH3
Xét: 17,53>5⇒17,53>5⇒ Hiệu suất tính theo N2N2
Vì các thể tích khí đo trong cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích cũng là tỷ lệ số mol
dA/H2 =5 —> MA = 10
BTKL —> mA = 175
—> nA = 17,5
Gọi nN2 phản ứng là a
—> nH2 phản ứng = 3a; nNH3 = 2a mol
—> nN2 dư = 5 - a; nH2 dư = 17,5 - 3a mol
—> 5 - a + 17,5 - 3a + 2a = 17,5
—> a = 2,5
—> H = 2,5/5 . 100% = 50%