Một nguyên tố kim loại R , oxit cao nhất của nó chứa 52,94% R về khối lượng
a) Tìm R
b) cho 20.4 oxit cao nhất của R tan hoàn toàn trong 246,6g dung dịch 17,76% của hợp chất với H của một phi kim X thuộc nhóm VIIA tạo thành dung dịch A
Tìm khối lượng nguyên tử và gọi tên X
Tính C% của dung dịch A

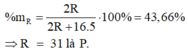
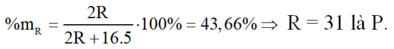

a.Gọi công thức oxit là R2On
Ta có :
\(\frac{2R}{2R+16n}\text{=0.5294}\)
\(\rightarrow\text{R=9n}\rightarrow\text{n=3 R=27 R là Al}\)
\(b,n_{Al2O3}=\frac{20,4}{102}=0,2\left(mol\right)\)
X thuộc nhóm VIIA\(\rightarrow\)Axit là HX
mHX=246,6.17,76%=43,8
\(\text{Al2O3+6HX-->2AlX3+3H2O}\)
0,2______1,2
\(M_{HX}=\frac{43,8}{1,2}\text{=36,5}\rightarrow\text{X=35,5 X là Clo}\)
mdd sau phản ứng=20,4+246,6=267g
\(C\%_{AlCl3}=\frac{\text{0,2.2.133,5}}{267}\text{=20%}\)
Đáp án:
a.R là Al
b.X là Clo
c%AlCl3=20%
Giải thích các bước giải:
a.Gọi công thức oxit là R2On
ta có 2R/(2R+16n)=0.5294
-->R=9n-->n=3 R=27 R là Al
b. nAl2O3=20,4/102=0,2
X thuộc nhóm VIIA-->Axit là HX
mHX=246,6.17,76%=43,8
Al2O3+6HX-->2AlX3+3H2O
0,2 1,2
-->M HX=43,8/1,2=36,5-->X=35,5 X là Clo
mdd sau phản ứng=20,4+246,6=267g
-->c%AlCl3=0,2.2.133,5/267=20%