Câu 4. Oxi hóa hoàn toàn 2,24 lít khí SO2 (đktc) trong điều kiện thích hợp thu được khí SO3. Hấp thụ hết lượng khí SO3 trên vào nước tạo thành 200 ml dung dịch X.a. Viết PTHH và xác định nồng độ mol của dung dịch X.b. Cho 3,25 gam kẽm vào dung dịch X. Tính lượng chất còn dư sau phản ứng?Câu 5. Cho 20,4 gam bột nhôm oxit Al2O3 tác dụng với dung dịch có chứa 78,4 gam axit sunfurica. Sau phản ứng, chất nào hết, chất nào...
Đọc tiếp
Câu 4. Oxi hóa hoàn toàn 2,24 lít khí SO2 (đktc) trong điều kiện thích hợp thu được khí SO3. Hấp thụ hết lượng khí SO3 trên vào nước tạo thành 200 ml dung dịch X.
a. Viết PTHH và xác định nồng độ mol của dung dịch X.
b. Cho 3,25 gam kẽm vào dung dịch X. Tính lượng chất còn dư sau phản ứng?
Câu 5. Cho 20,4 gam bột nhôm oxit Al2O3 tác dụng với dung dịch có chứa 78,4 gam axit sunfuric
a. Sau phản ứng, chất nào hết, chất nào dư? Dư bao nhiêu gam?
b. Tính khối lượng nhôm sunfat Al2(SO4)3 thu được.
Câu 6. Cho 1,35 gam nhôm tác dụng với 200 gam dung dịch axit sunfuric 3,92%.
a. Cho biết sau phản ứng, chất nào còn dư?
b. Tính thể tích khí (đktc) thu được?
c. Tính C% của chất tan trong dung dịch sau phản ứng?

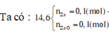


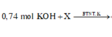

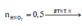
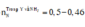
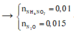
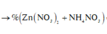
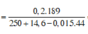
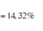
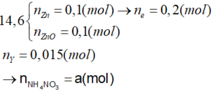
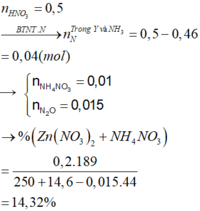

C2:
nS= 8/32=0.25 mol
nZn= 26/65=0.4 mol
Zn + S -to-> ZnS
0.25_0.25_____0.25
Chất rắn A: 0.15 mol Zn dư , 0.25 mol ZnS
Zn + 2HCl --> ZnCl2 + H2
0.15________________0.15
ZnS + 2HCl --> ZnCl2 + H2S
0.25__________________0.25
nhh khí = 0.15 + 0.25= 0.4 mol
Vì: %V= %n
nên:
%VH2= 0.15/0.4*100%= 37.5%
%VH2S= 0.25/0.4*100%=62.5%