Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

Đổi: 400ml = 0,4l
nHCl = CM.V = 0,4 (mol)
Pthh:
FeO + 2HCl -> FeCl2 + H2O
0,025 0,05 0,025
CaCO3 + 2HCl -> CaCl2 + H2O + CO2
0,1 0,2 0,1 0,1
nCO2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
=> mCaCO3 = M.n = 100 x 0,1 = 10 (g)
=> mFeO = 1,8 (g) => nFeO = 0,025 (mol)
=> nHCl(dư) = 0,4 - 0,2 - 0,05 = 0,15 (mol)
+) CMHCl(dư) = n/V = 0,15/0,4 = 0,375 mol
+) CMFeCl2 = n/V = 0,025/4 = 0,0625 mol
+) CMCaCl2 = n/V = 0,1/4 = 0,25 mol

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

\(n_{HCl}=0,3.2=0,6\left(mol\right)\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Vì:\dfrac{0,6}{2}>\dfrac{0,25}{1}\Rightarrow HCldư\\ Đặt:n_{Al}=t\left(mol\right);n_{Fe}=r\left(mol\right)\\ \left(t,r>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27t+56r=8,3\\1,5t+r=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}t=0,1\\r=0,1\end{matrix}\right.\\ \Rightarrow m_{Al}=0,1.27=2,7\left(g\right);m_{Fe}=0,1.56=5,6\left(g\right)\\ b,n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\Rightarrow m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\\ n_{Fe}=n_{FeCl_2}=0,1\left(mol\right)\Rightarrow m_{ddFeCl_2}=127.0,1=12,7\left(g\right)\\ m_{ddHCl}=300.1,15=345\left(g\right)\\ m_{ddsau}=8,3+345-0,25.2=352,8\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,6-0,25.2=0,1\left(mol\right)\\ \Rightarrow m_{ddHCl}=0,1.36,5=3,65\left(g\right)\\ C\%_{ddHCl\left(dư\right)}=\dfrac{3,65}{352,8}.100\approx1,035\%\\ C\%_{ddAlCl_3}=\dfrac{13,35}{352,8}.100\approx3,784\%\\ C\%_{ddFeCl_2}=\dfrac{12,7}{352,8}.100\approx3,6\%\)

Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO 2 (0,1 mol) vậy sản phẩm là muối Na 2 SO 3 . Ta có PTHH :
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
- Khối lượng của dung dịch sau phản ứng :
m dd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
m Na 2 SO 3 = 126.0,1 = 12,6g
m NaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C % Na 2 SO 3 = 12,6/150 x 100% = 8,4%
C % NaOH dư = 4/150 x 100% = 2,67%

Kí hiệu CO 2 và SO 2 là YO 2 => Σn YO 2 cần dùng = 0,25 mol
Chất tan sinh ra khi dung dịch NaOH hấp thụ tối đa YO 2 sẽ là NaHYO 3
YO 2 + NaOH → NaHYO 3
a = 0,25/0,5 = 0,5 (mol/l)
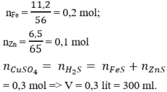

C2:
nS= 8/32=0.25 mol
nZn= 26/65=0.4 mol
Zn + S -to-> ZnS
0.25_0.25_____0.25
Chất rắn A: 0.15 mol Zn dư , 0.25 mol ZnS
Zn + 2HCl --> ZnCl2 + H2
0.15________________0.15
ZnS + 2HCl --> ZnCl2 + H2S
0.25__________________0.25
nhh khí = 0.15 + 0.25= 0.4 mol
Vì: %V= %n
nên:
%VH2= 0.15/0.4*100%= 37.5%
%VH2S= 0.25/0.4*100%=62.5%