1/ Cho phản ứng: H2SO4 đặc + Al → Al2(SO4)3 + H2S + H2O. Tổng hệ số cân bằng của H2SO4 đặc và Al là: (Nêu cách tính)
A. 19 B. 28 C. 25 D. 23
2/ Hòa tan 11,2 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với Vml dung dịch KMnO4 0,5M. Giá trị của V là:
A. 40 B. 80 C. 60 D.20
3/ Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư, khí sinh ra có tỷ khối so với hidro là 9. Thành phần % theo khối lượng Fe trong hỗn hợp ban đầu là:
A. 40% B. 38,89% C. 50% D. 61,11%
4/ Một hỗn hợp gồm 13 gam Zn và 5,6 gam Fe tác dụng với dung dịch H2SO4 loãng dư. Thể tích khí hidro (đktc) được giải phóng sau phản ứng là:
A. 2,24 lít B. 4,48 lít C. 6,72 lít D. 67,2 lít

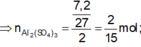
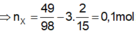

1,
b1, xd số mol chất khử và chất oxi hóa :
H2SO4 đặc + Al → Al2(SO4)3 + H2S + H2O.
nS= 6 nAl=0 nAl=3 nS=-2
b2, trừ các chất giống nhau từ trái qua phải (lưu ý là phải lấy gt tuyệt đối của hiệu sau khi trừ)
ta được nS=8
nAl=3 (đặt trc các chất bị oxi hóa nhé)
ta được
b4, đếm từng chất một thôi ,đếm số mol mỗi chất 2 bên cân bằng nhau nhé !
kết quả:
2, Fe⇒ Fe2+ ⇒Fe3+ nFe2+ = nFe = 0,2
Bảo toàn e nFe=5nMn7+⇒nMn7+=0.2/5=0.04
⇒VKMnO4= 0,04/0,5 = 0,00.08(l) =80(ml)
Chọn B