Giải bài 4 trang 84 sgk hóa 8
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




4.a)
nP=\(\dfrac{12,4}{31}\) 0,4 (mol).
n\(_{O_2}\)=\(\dfrac{17}{32}\)= 0,53 (mol).
PTHH :
4P + 5O2 → 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
4.b) Chất được tạo thành là P2O5 . Theo PTHH, ta có :
n\(_{P_2O_5}\)=\(\dfrac{1}{2}\)nP=12.0,4=0,2 (mol).
⇒m\(_{P_2O_5}\) = 0,2.(31.2 + 16.5) = 28,4(g)
5)PTHH:
C + O2 → CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
24. (0,5% + 1,5%) = 0,48kg = 480g.
Khối lượng cacbon nguyên chất là : 24 – 0,48 = 23,52 (kg) = 23520 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
V\(_{CO_2}\)=\(\dfrac{23520}{12}\).22,4= 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 → SO2
Khối lượng tạp chất lưu huỳnh là : 24.0,5% = 0,12 kg = 120 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
V\(_{SO_2}\)=\(\dfrac{120}{32}.22,4\)=84 (l).

Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)

Ví dụ 2x+7-5= 28
=> 2x+7=28-5
=>2x+7=23
=>2x =23-7
=>2x =16
=>x =16:2
=> x =8

PTHH: \(2C_4H_{10}+13O_2\underrightarrow{t^o}8CO_2+10H_2O\)

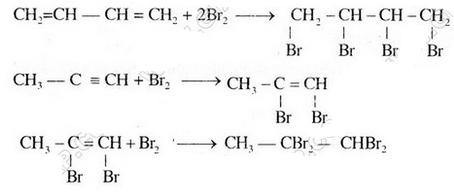
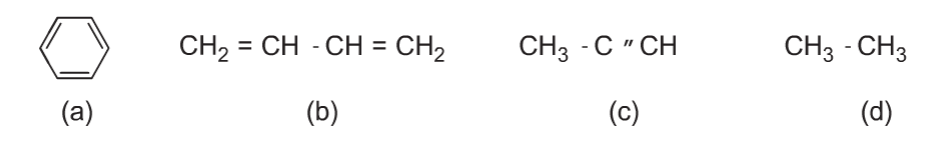
Chỉ có chất b và c làm mất màu dung dịch brom vì trong phân tử có liên kết đôi và liên kết ba tương tự etilen, axetilen.
Các phương trình phản ứng hóa học:

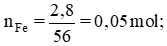
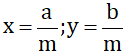 (a, b, m ∈ Z; m > 0) và x < y. Hãy chứng minh nếu chọn
(a, b, m ∈ Z; m > 0) và x < y. Hãy chứng minh nếu chọn 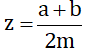 thì ta có x < z < y.
thì ta có x < z < y.
PTHH: \(4P+5O_2\underrightarrow{to}2P_2O_5\\ 0,4mol:0,5mol\rightarrow0,2mol\)
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{17}{32}=0,53\left(mol\right)\)
Ta có tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,53}{5}\)
Vậy P PƯ hết, Oxi PƯ dư.
a. \(n_{O_2du}=n_{O_2bd}-n_{O_2pu}\)
\(\Leftrightarrow n_{O_2du}=0,53-0,5=0,03\left(mol\right)\)
b. Chất tạo thành là \(P_2O_5\)
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)