Giải bài tập Hòa tan 14,7gam axitsunfuric vào nước thu được 500ml dung dịch D.Tính nồng độ cation có trong dung dịch D
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề: 9,2 gam Na
\(a,n_{Na_2O}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
0,4------------------>0,8
\(\rightarrow C_{M\left(NaOH\right)}=\dfrac{0,8}{0,5}=1,6M\)
\(b,n_{K_2O}=\dfrac{37,6}{94}=0,4\left(mol\right)\)
PTHH: \(K_2O+H_2O\rightarrow2KOH\)
0,4----------------->0,8
\(\rightarrow C\%_{KOH}=\dfrac{0,8.56}{362,4+37,6}.100\%=11,2\%\)

\(n_{K_2O}=\dfrac{23.5}{94}=0.25\left(mol\right)\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.25...................0.5\)
\(C_{M_{KOH}}=\dfrac{0.5}{0.5}=1\left(M\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(0.5............0.25............0.25\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.25\cdot98}{20\%}=122.5\left(g\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{122.5}{1.14}=107.5\left(ml\right)=0.1075\left(l\right)\)
\(C_{M_{K_2SO_4}}=\dfrac{0.25}{0.1075+0.5}=0.4\left(M\right)\)

Bài tập vận dụng
VD1: Hoà tan hoàn toàn 7,45 gam KCI vào 200ml H2O thu đưoc dung dịch A. Tính nồng độ %, nồng độ mol/l
của dung dịch A.
VD2: Hoà tan hoàn toàn 0,2 mol NaOH vào 500ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l
của dung dịch B.
VD3: Hoà tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H2O thu được dung dịch C. Tinh nồng độ
%, nồng độ mol/l của dung dịch C.
VD4: Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/I
của dung dịch D.
VD5: Hoà tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l
của dung dịch E.
VD6: Hoà tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400ml H2O thu đưoc dung dịch F. Tính nồng đo %,
nồng đo mol/l của dung dịch F.
VD1:
\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\\ V_{ddKCl}=V_{H_2O}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddKCl}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

Bài 3:
nKOH = 1.0,05 = 0,05 (mol);nHCl=0,5.0,5=0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,0125 0,0125
PTHH: 2KOH + FeCl2 → 2KCl + Fe(OH)2
Mol: 0,05 0,025
Ta có:\(\dfrac{0,25}{2}>\dfrac{0,0125}{1}\) ⇒ HCl dư, FeCl3 pứ hết
⇒ m=0,0125.56 = 0,7 (g)
Bài 4:
a,Nếu cho giấy quỳ tím vào dung dịch sau phản ứng thì màu của giấy quỳ tím sẽ không thay đổi màu sắc
b,\(n_{NaOH}=0,5.0,15=0,075\left(mol\right);n_{HCl}=1.0,15=0,15\left(mol\right)\)
PTHH: NaOH + HCl → NaCl + H2O
Mol: 0,075 0,075 0,075
Ta có:\(\dfrac{0,075}{1}< \dfrac{0,15}{1}\) ⇒ NaOH pứ hết , HCl dư
mNaCl = 0,075.58,5 = 4,3875 (g)
c, Vdd sau pứ = 0,15 + 0,15 = 0,3 (l)
\(C_{M_{ddNaCl}}=\dfrac{0,075}{0,3}=0,25M;C_{M_{ddHCldư}}=\dfrac{0,15-0,075}{0,3}=0,25M\)
Bài 5:
a,\(n_{BaCl_2}=\dfrac{100.20,8\%}{208}=0,1\left(mol\right);n_{Na_2SO_4}=\dfrac{150.14,2\%}{142}=0,15\left(mol\right)\)
PTHH: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Mol: 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\)⇒ BaCl2 pứ hết, Na2SO4 dư
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
b,mdd sau pứ = 100+150 = 250 (g)
\(C\%_{ddNaCl}=\dfrac{0,2.58,5.100\%}{250}=4,68\%\)
\(C\%_{ddNa_2SO_4dư}=\dfrac{\left(0,15-0,1\right).142.100\%}{250}=2,84\%\)
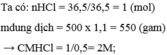
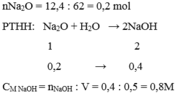
\(n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\\ \left[H_2SO_4\right]=\dfrac{0,15}{0,5}=0,3\left(M\right)\\ \Rightarrow\left[H^+\right]=0,3.2=0,6\left(M\right)\\ \left[SO^{2-}_4\right]=\left[H_2SO_4\right]=0,3\left(M\right)\)
Cation thì chỉ cần ion dương nha em, anh tính dư í