Một hợp chất có công thức AO bt trong 0.1 mol hợp chất có khối lượng là 16 g Tìm tên của A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


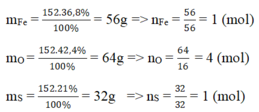
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.

\(M_{R_2O}=\dfrac{23,5}{0,25}=94\left(g/mol\right)\)
=> MR = 39(g/mol)
=> R là K
CTHH: K2O
\(M_A=\dfrac{23,5}{0,25}=94\\ Tacó:2R+16=94\\ \Rightarrow R=39\left(K\right)\\ \Rightarrow CTHH: K_2O\)

a)
Gọi CTHH là $Fe_xS_yO_z$
Ta có :
\(\dfrac{56x}{7}=\dfrac{32y}{6}=\dfrac{16z}{12}=\dfrac{400}{7+6+12}\)
Suy ra x = 2 ; y = 3; z = 12
Vậy CTHH là $Fe_2(SO_4)_3$ :Sắt III sunfat
b)
$n_X = \dfrac{60}{400} =0,15(mol)$
Số nguyên tử Fe = 0,15.2.6.1023 = 1,8.1023 nguyên tử
Số nguyên tử S = 0,15.3.6.1023 = 2,7.1023 nguyên tử
Số nguyên tử O = 0,15.12.6.1023 = 10,8.1023 nguyên tử

Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Khối lượng mol của Fe là \(M_{Fe}\) = (152 . 36,8)/100 = 56 g
Khối lượng mol của S là: \(M_S\) = (152 . 21)/100 = 32 g
Khối lượng mol của O là: \(M_O\) = (152 . 42,2)/100 = 64 g
Gọi công thức hóa học của hợp chất là \(Fe_xS_yO_z\), ta có:
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.z=64\Rightarrow z=4\)
Vậy hợp chât có công thức hóa học là \(FeSO_4\)


a, Theo ĐLBT KL, có: mA + mO2 = mCO2 + mH2O
⇒ mO2 = 13,2 + 5,4 - 4,2 = 14,4 (g)
b, \(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,6.1 = 4,2 (g) = mA
→ A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
⇒ x:y = 0,3:0,6 = 1:2
→ A có CTPT dạng (CH2)n.
\(\Rightarrow n=\dfrac{42}{12+2.1}=3\)
Vậy: A là C3H6.
c,- A làm mất màu dd Brom.
PT: \(C_3H_6+Br_2\rightarrow C_3H_6Br_2\)

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

a)
\(m_C=\dfrac{52,15.46}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{13,04.46}{100}=6\left(g\right)=>n_H=\dfrac{6}{1}=6\left(mol\right)\)
\(m_O=46-24-6=16\left(g\right)=>n_O=\dfrac{16}{16}=1\left(mol\right)\)
=> CTHH: C2H6O
b) \(n_A=\dfrac{18,4}{46}=0,4\left(mol\right)\)
mC = 12.0,4.2 = 9,6(g)
mH = 1.0,4.6 = 2,4 (g)
mO = 16.0,4.1 = 6,4 (g)
c) \(n_A=\dfrac{13,8}{46}=0,3\left(mol\right)\)
Số nguyên tử C = 2.0,3.6.1023 = 3,6.1023
Số nguyên tử H = 6.0,3.6.1023 = 10,8.1023
Số nguyên tử O = 1.0,3.6.1023 = 1,8.1023

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)