cho 1.38 g hỗn hợp X gồm fe và al tác dụng vừa đủ vs dd hcl dư thu dc 10.08 l h2 .mặt khác cho 9.2 hỗn hợp X tác dụng vs dung dịch h2so4 đặc nóng thì thu dc v ( l) khí so2.tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

1/2m hỗn hợp= 39,2
m muối tăng= mSO4-mCl
do nso4(2-)=1/2ncl-(bảo toàn điện tích hoặc có thể viết pt ra là thấy)
83,95-77,7=96.1/2.ncl-35,5ncl
ncl bị thay thế là 0,5
có ở phần 77,7. có btkluong 39,2+36,5.2.a=77.7+18a(a là n h20)
a=0,7 ----- tổng ncl = 1,4
n kloai là 77,7-1,4.35.5=28 ----- nfeo là x fe2o3 y (ở nửa phần) có 56x+112y=28......72x+160y=39,2
x=0,1 y=0,2
%feo=18,36...... fe203=81,64%
b, ncl còn lại=nhcl=1,4-0,5=0,9
nso4=1/2ncl=0.25=nh2so4
CM=(0,25+0,9)/0,5=2,3

Đáp án : D
Gọi số mol Al ; Zn ; Fe lần lượt là x ; y ; z
=> 27x + 65y + 56z = 20,4 (1)
Và 1,5x + y + z = nH2 = 0,45 (2)
Xét 0,2 mol X có lượng chất gấp t lần 20,4g X
=> t(x + y +z) = 0,2 mol (3)
Lại có : Bảo toàn e : 2nCl2 = (3x + 2y + 3z)t = 0,55 (4)
Từ (1),(2),(3),(4) => x = y = 0,1 ; z = 0,2
=> %mAl(X) = 13,24%

2Al+6HCl→2AlCl3+3H2
Zn+2HCl→ZnCl2+H2
2Al+6H2SO4→Al2(SO4)3+3SO2+6H2O
Zn+2H2SO4→ZnSO4+SO2+2H2O
Cu+2H2SO4→CuSO4+SO2+2H2O
nH2=0,3mol
nCu=0,15mol
Gọi a và b lần lượt là số mol của Al và Zn
27a+65b=17,25
3\2a+b=0,3
=> a=0,03, b=0,25
→nAl=0,03mol→mAl=1,62g
→nZn=0,25mol→mZn=32,5g
b)nHCl=3nAl+2nZn=0,59mol
→VHCl=0,592=0,295 l
c)
nAl2(SO4)3=1\2nAl=0,015mol
→mAl2(SO4)3=5,13g
nZnSO4=nZn=0,25mol
→mZnSO4=40,25g
nCuSO4=nCu=0,15mol
→mCuSO4=24g


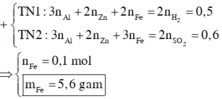
Fe + 2HCl → FeCl2 + H2 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Gọi số mol của Fe và Al lần lượt là \(x,y\)
Ta có: \(\left\{{}\begin{matrix}x+\dfrac{2}{3}y=0,45\\56x+27y=13,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (3)
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O (4)
Theo PT3: \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=\dfrac{3}{2}\times0,15=0,225\left(mol\right)\)
Theo PT4: \(n_{SO_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}\times0,2=0,3\left(mol\right)\)
\(\Rightarrow\Sigma n_{SO_2}=0,225+0,3=0,525\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,525\times22,4=11,76\left(l\right)\)