Cho 150g dung dịch HCl 14,6% phản ứng hoàn toàn với Al.
a) Tính khối lượng Al tham gia phản ứng và thể tích khí H2 sinh ra (đktc).
b) Nếu ban đầu người ta cho 10,8g Al vào 150g dung dịch HCl 14,6% thì sau phản ứng thu được m (g) chất rắn không tan. Lọc lấy phần chất rắn không tan này hòa tan trong H2SO4 đặc nóng. Tính thể tích H2SO4 90% (D = 1,8g/ml) tối thiểu cần dùng để hòa tan hết lượng chất rắn trên.

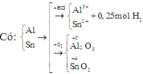



2Al + 6HCl -> 2AlCl3 + 3H2 (1)
nHCl=0,6(mol)
Từ 1:
nAl=\(\dfrac{1}{3}\)nHCl=0,2(mol)
nH2=\(\dfrac{1}{2}\)nHCl=0,3(mol)
mAl=27.0,2=5,4(mol)
VH2=22,4.0,3=6,72(lít)
b;
2Al + 6H2SO4 -> Al2(SO4)3 + 3SO2 + 6H2O (2)
mAl dư=10,8-5,4=5,4(g)
Từ 2:
nH2SO4=3nAl=0,6(mol)
mH2SO4=98.0,6=58,8(g)
mdd H2SO4=58,8:90%=65,3(g)
V=65,3.1,8=117,6(ml)
- Cậu ơi dòng cuối cùng mình tưởng công thức mdd = D.V. => V = 65,3 : 1,8 chứ