tìm số mol hỗn hợp 200ml dung dịch NaOH 0,1M và KOH 0,2M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nNaOH = 0,1.0,2 = 0,02 (mol)
nKOH = 0,2.0,2 = 0,04 (mol)
\(\Rightarrow\) nhỗn hợp = 0,02 + 0,04 = 0,06 (mol)

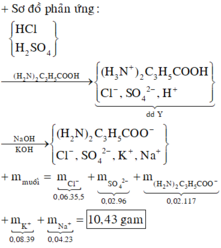
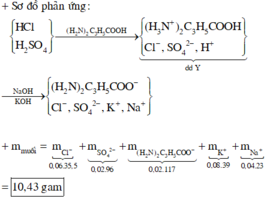
Coi dung dịch Y chứa ( H 2 N ) 2 C 3 H 5 C O O H : 0,02 mol
H 2 S O 4 : 0,02 mol
HCl : 0,06 mol
Y + 0,04 mol NaOH, 0,08 mol KOH → n H + = n O H − = 0 , 12 → Phản ứng vừa đủ
→ muối thu được có chứa ( H 2 N ) 2 C 3 H 5 C O O − : 0 , 02 m o l ; S O 4 2 − : 0 , 02 m o l ; C l − : 0 , 06 m o l , K + : 0 , 08 ; N a + : 0 , 04 → m m u o i = 10 , 43
Đáp án cần chọn là: C

Đáp án B
Quy trình: X + hỗn hợp axit + hỗn hợp bazơ vừa đủ.
⇒ ![]()
Bảo toàn khối lượng.
m = 0,02.118 + 0,02.98 + 0,06.36,5 + 0,04.40 + 0,08.56 – 0,12.18 = 10,43 gam.

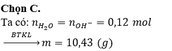
nhh = nNaOH + nKOH = 0,2 . (0,1 + 0,2) = 0,06 mol