
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ các chất trong 50mL dd X:
NaOH: 0.005 Mol
KOH: 0.005 Mol
Ba(OH)2: 0.01 Mol
Phản ứng của H2SO4 với Ba(OH)2:
H2SO4 + Ba(OH)2 -> BaSO4 + 2H2O
Số mol H2SO4 cần: 0.01 Mol
H+ + OH- -> H2O
Số mol H+ cần: 0.01 Mol => mol H2SO4 cần 0.005 mol.
Lượng mol H2SO4 tổng: 0.015 mol.
=> V H2SO4 = 0.015/0.1 = 0.15 L = 150 mL H2SO4 0.1M

a)
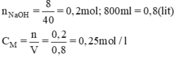
b) nNaOH có trong 200ml dung dịch NaOH 0,25M là

VH2O cần dùng để pha loãng 200ml dung dịch NaOH 0,25M để dung dịch NaOH 0,1M.
VH2O = 500 - 200 = 300ml H2O.

Gọi CTHH chung của axit là RCOOH
Đổi: \(\left\{{}\begin{matrix}75ml=0,075l\\25ml=0,025l\end{matrix}\right.\)
\(n_{NaOH}=0,075.0,2=0,015\left(mol\right)\)
\(n_{HCl}=0,025.0,2=0,005\left(mol\right)\)
PTHH: NaOH + HCl ---> NaCl + H2O
0,005<---0,005->0,005
=> nNaOH (phản ứng với axit hữu cơ) = 0,015 - 0,005 = 0,01 (mol)
mNaCl = 0,005.58,5 = 0,2925 (g)
=> mmuối Na hữu cơ = 1,0425 - 0,2925 = 0,75 (g)
PTHH:
RCOOH + NaOH ---> RCOONa + H2O (1)
Theo pthh (1): naxit = nH2O = nNaOH = 0,01 (mol)
Áp dụng ĐLBTKL:
\(m_{axit}+m_{NaOH}=m_{muối}+m_{H_2O}\\ \Leftrightarrow m_{axit}=0,75+0,01.18-0,01.40=0,53\left(g\right)\)
=> \(M_{RCOOH}=\dfrac{0,53}{0,01}=53\left(\dfrac{g}{mol}\right)\)
=> \(M_R=53-45=8\left(\dfrac{g}{mol}\right)\)
=> \(m_{C\left(R_1\right)}< 8< m_{C\left(R_2\right)}\)
=> \(n_{C\left(R_1\right)}< \dfrac{2}{3}< n_{C\left(R_2\right)}\)
Mà số nguyên tử cacbon là số nguyên không âm
=> Một axit có 0 nguyên tử cacbon và một axit có 1 nguyên tử cacbon
=> 2 axit lần lượt là HCOOH và CH3COOH
P/s: CTHH dạng chung là CnH2n+1COOH nhé :)

nNaOH trong 200ml dung dịch NaOH 1M
nNaOH = 0.2 x 1 = 0.2 (mol)
Trong dd NaOH 0.2M
=> V = 0.2 x 0.2 = 0.4l = 400ml
Cần thêm 400ml-200ml = 200ml nước
Dùng 200ml nước và 200ml ddNaOH 1M pha chế NaOH 0.2M


nhh = nNaOH + nKOH = 0,2 . (0,1 + 0,2) = 0,06 mol