Một hỗn hợp gồm Fe2O3 và MgO nặng 16g được hoà tan hoàn tan hết trong dung dịch HCl, sau đó đem cô cạn được 35.25 muối khan. Thành phần % khối lượng mỗi oxit trong hỗn hợp ban đầu là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ở phần b, nếu trong hỗn hợp đầu thì phải là % khối lượng mỗi oxit chứ nhỉ? Và ở phần c phải là 1,1 g/ml chứ không phải g/mol bạn nhé!


Bạn tham khảo link nhé!
một hỗn hợp gồm Fe2O3 và MgO nặng 16g được hòa tan hết trong udng dịch axit HCL sau đó đem cô cạn dung dịch thu được 35,25g muối khan a) viết các PTHH b) tính thành phần % khối lượng mỗi oxit trong hỗn hợp ban đầu >< giúp với ạ - Hoc24

a) Fe2O3+6HCl--->2FeCl3+3H2O
x---------------------------2x(mol)
MgO+2HCl-->MgCl2+H2O
y-----------------y(mol)
b) Gọi n Fe2O3=x, n MgO=y
theo bài ra ta có hpt
\(\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,32\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
%m Fe2O3=0,05.160/16.100%=50%
%m MgO=100-50=50%
a) Fe2O3+6HCl--->2FeCl3+3H2O
x---------------------------2x(mol)
MgO+2HCl-->MgCl2+H2O
y-----------------y(mol)
b) Gọi n Fe2O3=x, n MgO=y theo bài ra ta có :
{ 160x + 40y = 16 325x + 95y = 35, 32
{ x = 0, 05 y = 0, 2
%mFe2o3=0,05.160/16.100%=50%
%mMgO=100-50=50%

\(n_{H_2SO_4}=0,4.0,5=0,2\left(mol\right)\)
=> \(n_{H_2O}=0,2\left(mol\right)\)
Theo ĐLBTKL: moxit + mH2SO4 = mmuối + mH2O
=> mmuối = 8 + 0,2.98 - 0,2.18 = 24 (g)
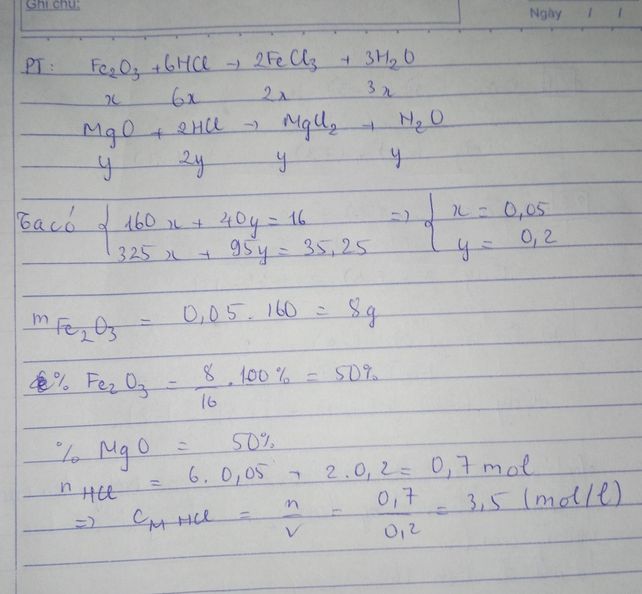




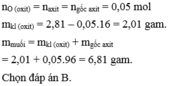
PTPƯ:
Fe2O3 + 6HCl -> 2FeCl3 +3H2 (1)
..x.............6x..........2x...........3x
MgO + 2HCl -> MgCl2 + H2O (2)
..y..........2y..........y...........y
Từ (1) và (2) ta có \(\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,25\end{matrix}\right.\)=>\(\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
mFe2O3 = 0,05.160 = 8 g
C%Fe2O3 = \(\dfrac{8}{16}\).100% = 50%
C%MgO = 100% - 50% = 50%
mấy cái x..... 6x...
y.. ..2y.... là sao ạ