trong phòng thí nghiệm dùng V hỗn hợp CO và H2 trong đktc để khử hoàn toàn hỗn hợp gồm 0,2 mon fe3o4 , 0,1 mol fe2o3.tính giá trị của V và số gam sắt thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của các phản ứng:
4CO + Fe3O4 → 3Fe + 4 CO2 (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b)Theo phương trình phản ứng trên ta có:
Muốn khử 1 mol Fe3O4 cần 4 mol CO.
Muốn khử 0,2 mol Fe3O4 cần x mol CO.
x= 0,2.4 = 0,8 mol CO.
VCO = 0,8 .22,4 = 17,92 lít.
Muốn khử 1 mol Fe2O3 cần 3 mol H2.
Muốn khử 0,2 mol Fe2O3 cần y mol H2.
y = 0,2 .3 = 0,6 mol.
VH2= 0,6 .22,4 = 13,44l.
c) Ở phản ứng (1) khử 1 mol Fe3O4 được 3 mol Fe.
Vậy khử 0,2 mol Fe3O4 được 0,6 mol Fe.
mFe = 0,6 .56 = 33,6g Fe.
Ở phản ứng (2) khử 1 mol Fe2O3 được 2 mol Fe.
Vậy khử 0,2 mol Fe2O3 được 0,4 mol Fe.
mFe = 0,4 .56 = 22,4g Fe.

Ta có :
\(\dfrac{m_{FeO}}{m_{Fe_2O_3}}=\dfrac{9}{20}\Rightarrow\dfrac{72n_{FeO}}{160n_{Fe_2O_3}}=\dfrac{9}{20}\Rightarrow\dfrac{n_{FeO}}{n_{Fe_2O_3}}=\dfrac{9}{20}:\dfrac{72}{160}=1\)
Do đó, ta coi X chỉ gồm $Fe_3O_4$
$n_{Fe} = \dfrac{29,4}{56}= 0,525(mol)$
\(Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\)
0,175 0,7 0,525 (mol)
$V = (0,7 : 80\%).22,4 = 19,6(lít)$
$m = (0,175 :80\%).232 = 50,75(gam)$

\(\left[O\right]_{KL}+H_2->H_2O\\ n_{H_2O}=n_{H_2}=\dfrac{14,4}{18}=0,8mol\\ v=0,8.22,4=17,92L\\ m_{KL}=m=47,2-16.0,8=34,4g\)

Đáp án B
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có:
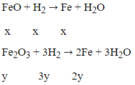
Có: x + 3y = 0,05 và 72x +160y = 3,04
⇒ x = 0,02mol; y = 0,01mol

Vậy VSO2 = 0,01 . 22,4 = 0,224 lít hay 224ml
mFe=0,2.3.56+0,1.2.56=44,8(g)
Cứ 0,2 mol Fe3O4 thì có 0,8 mol CO,H2 tham gia
Cứ 0,1 mol Fe2O3 thì có 0,3 mol CO,H2 tham gia
VH2.CO=1,1.22,4=24,64(lít)