Trong hợp chất XHn có chưa 17,65% là hiđro. Biết hợp chất này có tỉ khối vs khí Metan CH4 là 1,0625. X là nguyên tố nào
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


phân tử khối của XHn=1,0625.(12+4)=17
=> % MH=\(\frac{n.1}{17}.100=17,65\)
=> n\(\)=3
=> X=17-3=14=> X là Nito (N)

Công thức hoá học của hợp chất có dạng XH 3 .
17,65% ứng với (3 x 1)đvC
(100 - 17,65)% ứng với 82,35x3/17,65 = 14(đvC)
Nguyên tử X có nguyên tử khối là 14, vậy nguyên tố X là nitơ (N).

a/
Trong A có %0 = \(\frac{x16}{2R+x16}\)= \(\frac{22,22}{100}\)
<=> 1600x = 44,44R + 355,52 K
<-> 44,44R = 1244,48x
=> R=28x
=> x = 2 => R=56=> R là Fe
Trong B %0=\(\frac{y.16}{2R+16y}=\frac{30}{100}\)
<=> 1600y=60R+480y
<=> 60R=1120x
=> R=\(\frac{56}{3}x\)
=> y = 3 => R=56=> R là Fe
=> CTHH của A;B lần lượt là
Feo và Fe\(_2\)0\(_3\)

Gọi phi kim cần tìm là X
=> hợp chất hiđro của X là: XH 3
Ta có: phần trăm khối lượng của hiđro trong hợp chất là 17,65%
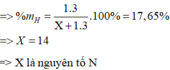
Đáp án: B

MX = 8,5.2 = 17 (g/mol)
\(m_N=\dfrac{17.82,35}{100}=14\left(g\right)=>n_N=\dfrac{14}{14}=1\left(mol\right)\)
\(m_H=\dfrac{17,65.17}{100}=3\left(g\right)=>n_H=\dfrac{3}{1}=3\left(mol\right)\)
=> CTHH:NH3
\(M_X=8,5.2=17(g/mol)\)
Trong 1 mol X: \(\begin{cases} n_N=\dfrac{17.82,35\%}{14}=1(mol)\\ n_H=\dfrac{17.17,65\%}{1}=3(mol) \end{cases}\)
Vậy \(CTHH_X:NH_3\)

Chỗ 1,0625 phải là 1,065 nha....Mik hơi nhầm
Ta có: %X = 100% - 17,65% = 82,25%
dXHn/CH4 = \(\dfrac{M_{XHn}}{M_{CH4}}\) = 1,065
=> MXHn= 1,065 . MCH4 = 1,065 . 16 = 17 (g/mol) (*)
Theo bài ra ta có:
\(\dfrac{\%X}{\text{%H}}\) = \(\dfrac{m_X}{m_H}\) = \(\dfrac{NTK\left(X\right)}{n}\) = \(\dfrac{82,35\%}{17,65\%}\) = \(\dfrac{82,35}{17,65}\)
⇔ NTK(X) . 17,65 = 82,35n
⇔ NTK(X) = \(\dfrac{82,35n}{17,65}\) ≈ 4,67n (**)
Từ(*) có: MXHn = PTK(XHn) = NTK(X) + NTK(H)n = 17
⇔ NTK(X) + n.1 = 17 (***)
Thế (**) vào (***) ta có:
4,67n + n = 17
⇔ 5,67n = 17
⇔ n = 17 : 5,67 = 3
Thế n vào (**): NTK(X) = 4,67 . 3 = 14 (đvC)
=> X là Nitơ, KHHH là N
Vậy...