Đốt cháy hoàn toàn 5,7 gam hợp chất hữu cơ X phai dùng vừa hết 8,4 lít khí oxi (dktc) sản phẩm cháy chỉ có CO2 và H2O theo tỉ lệ 44 : 15 về khối lượng. tìm công thức hóa hoc của X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức cần tìm là: CxHy.
CxHyOz + (x+y/4-z/2)O2 ---> xCO2 + y/2H2O
a mol (x+y/4-z/2)a ax ay/2
Số mol O2 = 8,4/22,4 = 0,375 mol.
Theo đề bài ta có: (12x + y + 16z)a = 5,7; (x + y/4 - z/2)a = 0,375; 44ax:9ay = 44:15
Suy ra: x/y = 3/5 hay x = 0,8y thay vào 2 phương trình trên ta có: (10,6y + 16z)a = 5,7 và (1,05y - 0,5z)a = 0,375
Suy ra: (10,6y + 16z):(1,05y -0,5z) = 15,2. Suy ra: 5,36y = 23,6z hay y = 4,4z

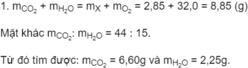
Khối lương C: 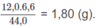
Khối lượng H: 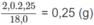
Khối lượng O: 2,85 - 1,80 - 0,25 = 0,80 (g).
Chất X có dạng CxHyOz
x : y : z = 0,150 : 0,25 : 0,050 = 3 : 5 : 1
Công thức đơn giản nhất của X là C 3 H 5 O .
2, M X = 3,80 x 30,0 = 114,0 (g/mol)
( C 3 H 5 O ) n = 114; 57n = 114 ⇒ n = 2.
Công thức phân tử C 6 H 10 O 2 .

Ta có: \(n_{O_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Theo ĐLBT KL, có: mX + mO2 = mH2O + mCO2 + mN2.
⇒ 44nCO2 + 28nN2 = 8,9 + 0,375.32 - 6,3 = 14,6 (1)
Mà: \(n_{CO_2}+n_{N_2}=\dfrac{7,84}{22,4}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,3\left(mol\right)=n_C\\n_{N_2}=0,05\left(mol\right)\Rightarrow n_N=0,05.2=0,1\left(mol\right)\end{matrix}\right.\)
- Đốt cháy X thu CO2, H2O và N2 → X chứa C, H, N, có thể có O.
Ta có: \(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\Rightarrow n_H=0,35.2=0,7\left(mol\right)\)
⇒ mC + mH + mN = 0,3.12 + 0,7.1 + 0,1.14 = 5,7 (g) < 8,9 (g)
Vậy: X chứa C, H, O và N.
⇒ mO = 8,9 - 5,7 = 3,2 (g) \(\Rightarrow n_O=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTPT của X là CxHyOzNt.
\(\Rightarrow x:y:z:t=0,3:0,7:0,2:0,1=3:7:2:1\)
Vậy: CTĐGN của X là C3H7O2N.

Ta có CTPT: Cx Hy O
Suy ra: n CO2 = x (mol) Suy ra: m CO2 = 44x ( g)
Suy ra: n H2O = 0,5y (mol) Suy ra: m H2O = 9y ( g)
Ta lại có:44x/9y = 44/27
Suy ra: x/y = 1/3
Suy ra Công thức hóa học phân tử A là C2H6O.
T hỏi đứa bạn câu này rồi nó gửi lại cho t. Sai thì thôi nhé !!!
Ko chắc lắm đâu![]()

Ba chất đồng phân có công thức phân tử giống nhau. Đốt X ta chỉ được C O 2 và H 2 O , vậy các chất trong X có chứa C, H và có thể có chứa O.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m X + m O 2 = 5,1(g)
Mặt khác mCO2: mH2O = 11:6
Từ đó tìm được: m C O 2 = 3,30 g và m H 2 O = 1,80 g
Khối lượng C trong 3,30 g
C
O
2
: 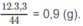
Khối lương H trong 1,80 g
H
2
O
: 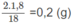
Khối lượng O trong 1,50 g X : 1,50 - 0,9 - 0,2 = 0,4 (g).
Các chất trong X có dạng C x H y O z
x : y : z = 0,075 : 0,2 : 0,025 = 3 : 8 : 1.
Công thức đơn giản nhất là C 3 H 8 O .
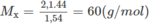
⇒ CTPT cũng là C 3 H 8 O .
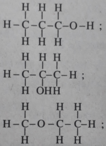

HD:
Gọi CTHH của X là CxHyOz.
CxHyOz + (x + y/2 - z/4)O2 ---> xCO2 + y/2H2O
Số mol O2 = 10,08/22,4 = 0,45 mol. Khối lượng O2 = 32.0,45 = 14,4 g.
Áp dụng ĐLBTKL ta có: m + 14,4 = 13,2 + 7,2 (m là khối lượng của X). Thu được: m = 6 g.
Khối lượng C = 12.13,2/44 = 3,6 g; Khối lượng H = 2.7,2/18 = 0,8 g; khối lượng O = 6 - 3,6 - 0,8 = 1,6 g.
Như vậy: 12x:y:16z = 3,6:0,8:1,6 hay x:y:z = 0,3:0,8:0,1 = 3:8:1. suy ra X có CT: C3H8O.
Hỗn hợp có tỉ khối H2 14.75
=> Khối lượng trung bình hh là : 14.75*2 =29.5
Ta có:
O2 (32)..............1.5
..............29.5
N2 (28)...............2.5
Vậy O2/N2 = 1.5 / 2.5 = 0.6
2)
A + O2 ---> CO2 + H2O
Trong A chắc chắn có C và H :
số mol CO2 = 0.3 mol => nC = 0.3 ; nO = 0.6
Số mol H2O = 0.4 mol => nH = 0.8 ; nO = 0.4
Số mol O2 = 0.45 mol => nO = 0.9
....
Tổng số mol Nguyên Tử O trong Sản Phẩm là : 0.6 + 0.4 =1 > 0.9
Vậy là Trong A có Nguyên tố O
1 - 0.9 = 0.1 mol
....
Coi Công thức A : CxHyOz thì ta có tỉ lệ
x : y : z = 0.3 : 0.8 : 0.1 = 3 : 8 :1
Vậy Công thức A là : C3H8O

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
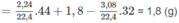
Khối lượng C trong 1,8 g A là: 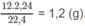
Khối lượng H trong 1,8 g A là: 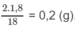
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
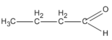 (butanal)
(butanal)
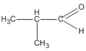 (2-metylpropanal)
(2-metylpropanal)
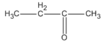 (butan-2-ol)
(butan-2-ol)

nC = nCO2 = 0,3
nH = 2nH2O = 0,7
nN = 2nN2 = 0,1
=> nO = (mA – mC – mH – mN)/16 = 0,2
=>; C : H : N : O = 3 : 7 : 1 : 2
nA = nO2 = 0,05
=>MA = 89
=>A là C3H7NO2
Bài 1
\(n_{CO_2}=\dfrac{13.2}{44}=0.3\left(mol\right)\Rightarrow n_C=0.3\left(mol\right)\Rightarrow m_C=3.6\left(g\right)\)
\(n_{H_2O}=\dfrac{6.3}{18}=0.35\left(mol\right)\Rightarrow n_H=0.7\left(mol\right)\)
\(n_{N_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\Rightarrow n_N=0.1\left(mol\right)\Rightarrow m_N=0.1\cdot14=1.4\left(g\right)\)
\(m_O=8.9-3.6-0.7-1.4=3.2\left(g\right)\)
\(n_O=\dfrac{3.2}{16}=0.2\left(mol\right)\)
\(Gọi:CTHH:C_xH_yO_zN_t\)
\(x:y:z:t=0.3:0.7:0.2:0.1=3:7:2:1\)
\(CTđơngarin\::C_3H_7O_2N\)