Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(BTKL:\)
\(m+0.4\cdot2=28.4+7.2\)
\(\Rightarrow m=34.8\left(g\right)\)
\(b.\)
\(m_{Fe}=0.59155\cdot28.4=16.8\left(g\right)\)
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(PTHH:\)
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_{H_2}}=\dfrac{0.3}{0.4}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)

- Cho phản ứng xảy ra hoàn toàn (2 chất trong A có sắt và oxit khác oxit sắt ban đầu)
\(yH_2+Fe_xO_y\rightarrow\left(t^o\right)xFe+yH_2O\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ n_{H_2\left(2\right)}=n_{Fe\left(2\right)}=n_{Fe\left(1\right)}=0,3\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4\left(mol\right)\\ BTKL:m_{H_2}+m_{oxit}=m_A+m_{H_2O}\\ \Leftrightarrow0,4.2+m=28,4+18.0,4\\ \Leftrightarrow m=34,8\left(g\right)\\ b,x:y=0,3:0,4=3:4\Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

a, Số mol các chất: \(nH_2=\dfrac{8,96}{22}.4=0,4\left(mol\right)\)
Số mol \(H_2O=\dfrac{7,2}{18}=0,4\left(mol\right)\)
=> Số mol nguyên tử Oxi là 0,4 mol
\(\Rightarrow m_O=0,4.16=6,4\left(g\right)\)
Vậy khối lượng FexOy ban đầu bằng kl hh 2 chất rắn sau phản ứng cộng với kl nguyên tử Oxi mất đi từ
\(Fe_xO_y\): \(m=28.4+6,4=34,8\left(g\right)\)
b, Trong hỗn hợp A kl sắt đôn chất là:
\(m_{Fe}=59,155.28,4=16,8\left(g\right)\Rightarrow n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
Gọi CT của Oxit sắt là \(Fe_xO_y\left(x;y>0\right)\)
Ta có:
\(Fe_xO_y+yH_2\underrightarrow{to}xFe+yH_2O\) (*)
\(.........y.....x.....y\)
\(..0,4mol...0,3mol..0,4mol\)
Theo (*): \(\dfrac{x}{y}=\dfrac{0,3}{0,4}=\dfrac{3}{4}\Rightarrow x=3;y=4\)
Vậy CT của Oxit sắt cần tìm là: \(Fe_3O_4\)

PTHH: \(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Đặt \(\left\{{}\begin{matrix}n_{Fe\left(oxit\right)}=a\left(mol\right)=n_{H_2}\\n_{O\left(oxit\right)}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(m_{tăng}=m_{Fe}-m_{H_2}\) \(\Rightarrow56a-2a=3,24\) \(\Rightarrow a=n_{Fe}=0,06\left(mol\right)\)
Hỗn hợp D gồm \(\left\{{}\begin{matrix}n_{CO_2\left(dư\right)}=c\left(mol\right)\\n_{H_2O}=n_{O\left(oxit\right)}=b\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}c+b=0,1\\18b+2c=7,4\cdot2\cdot\left(b+c\right)\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}b=0,08\\c=0,02\end{matrix}\right.\)
\(\Rightarrow x:y=a:b=0,06:0,08=3:4\)
\(\Rightarrow\) Công thức cần tìm là Fe3O4

a)
yH2 + FexOy --> xFe + yH2O
nH2 = 8,96/22,4 = 0,4 (mol)
nH2O = 7,2/18 = 0,4 (mol)
=> H2 đã phản ứng hết hay FexOy dư
mH2 = 2.0,4 = 0,8 (g)
Ta có m = mA + mH2O - mH2 = 28,4 + 7,2 - 0,8 = 34,8 (g)
b)
Trong A chứa 59,155% Fe
=> mFe = 59,155%.28,4 = 16,8 (g)
=> nFe = 16,8/56 = 0,3 mol
Từ pt pư ta có
x/y = nFe/nH2 = 0,3/0,4 = 3/4
=> Oxit sắt đã dùng là Fe3O4
a)
yH2 + FexOy \(\rightarrow\) xFe + yH2O
nH2 = \(\dfrac{8,96}{22,4}\) = 0,4 (mol)
nH2O = \(\dfrac{7,2}{18}\) = 0,4 (mol)
=> H2 đã phản ứng hết hay FexOy dư
mH2 = 2.0,4 = 0,8 (g)
Ta có m = mA + mH2O - mH2 = 28,4 + 7,2 - 0,8 = 34,8 (g)
b)
Trong A chứa 59,155% Fe
=> mFe = 59,155%.28,4 = 16,8 (g)
=> nFe = \(\dfrac{16,8}{56}\) = 0,3 mol
Từ pt pư ta có
x/y = nFe/nH2 = \(\dfrac{0,3}{0,4}\) = 3/4
=> Oxit sắt đã dùng là Fe3O4

a/ \(n_{H_2}=\frac{8,96}{22,4}=0,4\)
\(\Rightarrow m_{H_2}=2.0,4=0,8\)
Theo định luật bảo toàn khối lượng thì:
\(m_{H_2}+m=m_{H_2O}+m_r\)
\(\Leftrightarrow m=m_{H_2O}+m_r-m_{H_2}=7,2+28,4-0,8=34,8\)
Oxit sắt chỉ có 3 loại là FeO, Fe2O3, Fe3O4 bạn xem thử có cái nào mà tỷ lệ Fe là 59,155% không mà bảo mình làm. Đề sai thì bỏ thôi b

1)yH2 + FexOy --> xFe + yH2On
H2 = 8,96/22,4 = 0,4 (mol)
nH2O = 7,2/18 = 0,4 (mol)
=> H2 đã phản ứng hết hay FexOy dư
mH2 = 2.0,4 = 0,8 (g)
Ta có m = mA + mH2O - mH2 = 28,4 + 7,2 - 0,8 = 34,8 (g)
2)Trong A chứa 59,155% Fe=
> mFe = 59,155%.28,4 = 16,8 (g)
=> nFe = 16,8/56 = 0,3 mol
Từ pt pư ta cóx/y = nFe/nH2 = 0,3/0,4 = 3/4=> Oxit sắt đã dùng là Fe3O4

Đáp án D.
Ta có: mO = 0,32 (g) ⟹ nO = 0 , 32 16 = 0,02 (mol) nên số mol của hỗn hợp CO, H2 cũng bằng 0,02 (mol) ⟹ V = 0,02.22,4 = 0,448 (l).
Theo định luật bảo toàn khối lượng, m = 16,8 – 0,02.16 = 16,48 (g).


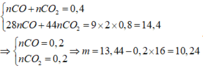
a)
nH2 = 8.96/22.4 = 0.4 (mol) => mH2 = 0.4x2 = 0.8 (g)
yH2 + FexOy --to--> xFe + yH2O
theo đlbtkl ta có:
mH2 + mFexOybanđầu = mFe + mFexOydư + mH2O
<=> 0.8 + m = 28.4 + 7.2
=> m = 34.8 (g)
b)
mFe = 28,4x59,155% = 16.8 (g) => nFe = 16.8/56 = 0.3 (mol)
yH2 + FexOy --to--> xFe + yH2O
0.4______________0.3
=> x : y = 0.3 : 0.4 = 3 : 4 => Fe3O4
a) \(n_{H_2\left(đầu\right)}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,4.10^{23}}{6.10^{23}}=0,4\left(mol\right)\)
Bảo toàn H2:
\(n_{H_2phảnứng}=n_{H_2O}=0,4mol\)
Áp dụng định luật bảo toàn khối lượng ta có:
m = 0,4.18 + 28,4 - 0,4.2 = 34,8 (g)
b) yH2 + FexOy \(\underrightarrow{t^o}\) xFe + yH2O
\(m_{Fe_xO_y\left(X\right)}=28,4.\left(100\%-59,155\%\right)=11,6\left(g\right)\)
\(m_{Fe_xO_yphảnứng}=31,8-11,6=23,2\left(g\right)\)
\(n_{Fe\left(X\right)}=n_{Fe\left(Fe_xO_yphảnứng\right)}=\dfrac{28,4.59,155\%}{56}=0,3\left(mol\right)\)
\(n_O=n_{H_2O}=0,4mol\)
x : y = 0,3 : 0,4 = 3 : 4
⇒ CT: Fe3O4