Cho Hỗn hợp gồm K Na 25,25g tan hết vào nước thu được 200ml dd A và 8,4l H2 ,Cho dung dịch A vào 200ml AlCl3 1M. Tính khối lượng kết tủa thu được ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B.
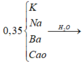
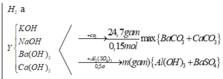
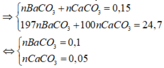
nK + nNa = 0,35 – 0,15 = 0,2 => nH2 = 0,2/2 + 0,1 = 0,2 = a => nAlCl3 dùng = 0,2
=> nAl3+ = 0,2 mà nOH- = 0,2 + 0,15×2 = 0,5 < 0,1×3 => Al(OH)3 chưa đạt kết tủa tối đa
nAl(OH)3 = 0,5/3 => mKết tủa = 27×0,5/3 = 4,5 gam.

Gọi \(\left\{{}\begin{matrix}n_{Al_2O_3}=a\left(mol\right)\\n_{Na}=b\left(mol\right)\\n_K=c\left(mol\right)\end{matrix}\right.\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
2K + 2H2O --> 2KOH + H2
=> 0,5b + 0,5c = 0,025
\(n_{OH^-}=b+c=0,05\left(mol\right)\)
\(n_{H^+}=0,08.1=0,08\left(mol\right)\)
Al2O3 + 2OH- --> 2AlO2- + H2O
a--->2a---------->2a
=> \(Y\left\{{}\begin{matrix}n_{AlO_2^-}=2a\left(mol\right)\\n_{OH^-}=0,05-2a\left(mol\right)\end{matrix}\right.\)
H+ + OH- --> H2O
(0,05-2a)<--(0,05-2a)
AlO2- + H+ + H2O --> Al(OH)3
2a------------->2a
Al(OH)3 + 3H+ --> Al3+ + 3H2O
0,03--->0,01
=> \(n_{AlCl_3}=n_{Al^{3+}}=0,01\left(mol\right)\)
=> \(m_{AlCl_3}=0,01.133,5=1,335\left(g\right)\)

Đáp án B
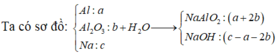
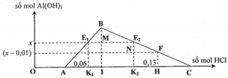
Khi cho 0,06 mol HCl ⇒ m gam kết tủa. Thêm tiếp vào (0,13–0,06) = 0,07 mol thì số mol kết tủa giảm 0,01 mol.
⇒ Khi cho 0,06 mol HCl vào thì kết tủa chưa đạt cực đại. Với 0,13 mol HCl thì số mol kết tủa đã đạt cực đại và bị hòa tan lại.
⇒ Sau khi phản ứng với 0,06 mol HCl thì số mol NaAlO2 còn lại = 0 , 07 - 0 , 01 × 3 4 = 0 , 01 m o l
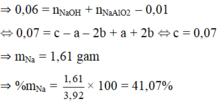

Đáp án C
4,667 gam hh Na, K, Ba, ZnO trong đó %O = 5,14% + H2O → ddX + 0,032 mol H2
n O = 4 , 667 × 5 , 14 % 16 = 0 , 015 mol → nZnO = 0,015 mol.
M + nH2O → Mn+ + nOH- + 0,5nH2
nOH- = 2 x nH2 = 0,032 x 2 = 0,064 mol.
ZnO + 2OH- → ZnO22- + H2O
0,015--0,03----0,015
ddX gồm 0,034 mol OH-; 0,015 mol ZnO22-
• ddX + 0,088 mol H+
OH- + H+ → H2O
0,034--------0,034
ZnO22- + 2H+ → Zn(OH)2
0,015--------0,03
Zn(OH)2 + 2H+ → Zn2+ + 2H2O
0,012--------0,024
→ nZn(OH)2 = 0,015 - 0,012 = 0,003 mol → m↓ = 0,297 gam





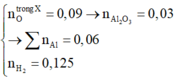
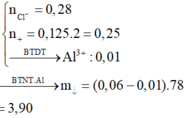
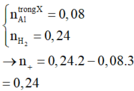
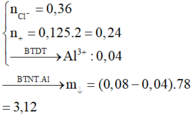
Cho hỗn hợp K và Na vào nước thu được dd A và có khí bay ra:
ta có : \(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
\(H_2O\rightarrow OH^-+H^+\)
0,375--- 0,375 ---- 0,375
Cho dung dịch A vào AlCl3
Pt: \(3OH^-+Al^{3+}\rightarrow Al\left(OH\right)_3\)
0,375 ------------------ 0,125
\(m_{ktua}=0,125.78=9,75\left(g\right)\)
Lần đầu giải ion không biết đúng không ' '