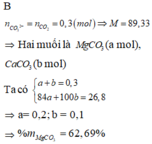Nếu thành phần phần trăm về khối lượng của mội kim lọa X trong muối cacbonat(gốc CO3) là 40 phần trăm thì thành phần phần trăm về khối lượng của kim lọai đó trog muối photphat(gốc PO4) là bao nhiêu ? THANKS
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\dfrac{R.100\%}{R+60}=40\%\)\(\Rightarrow R=40\left(Ca\right)\)
\(\Rightarrow\%Ca\left(trongCa_3PO_4\right)=\dfrac{40.3.100}{40.3+31+16.4}=55,81\%\)

Giải thích: Đáp án B
Xét trong 1 mol hỗn hợp :
- Gọi x là số mol MCl2 thì số mol của MSO4 là 1 - x
- Số mol của M : x + 1 - x = 1 mol
=> Khối lượng hỗn hợp là : (M + 71)x + (M + 96)(1 - x) = M + 96 - 25x
Phần trăm khối lượng M trong hỗn hợp là :
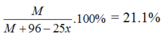
Ta có 0 < x < 1 => 18.9 < M < 25.7 => M = 24 (Mg)
=> x = 0.25 mol
=> khối lượng hỗn hợp là (24 + 71). 0,25 + (M + 96)(1 – 0,25) = 113.75g
=> %Cl = 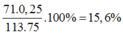

CTHH muối cacbonat: R2(CO3)n
CTHH muối photphat: R3(PO4)n
Xét R2(CO3)n
\(\%R=\dfrac{2.M_R}{2.M_R+60n}.100\%=40\%\)
=> 2.MR = 0,8.MR + 24n
=> 1,2.MR = 24n
=> \(M_R=20n\) (g/mol)
Xét R3(PO4)n
\(\%R=\dfrac{3.M_R}{3.M_R+95n}.100\%=\dfrac{3.20n}{3.20n+95n}.100\%=38,71\%\)

Câu 1 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%P = \dfrac{31.2}{3M + 95.2}.100\% = 20\%$
$\Rightarrow M = 40(Ca)$
Vậy muối là $Ca_3(PO_4)_2$
Câu 2 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%M = \dfrac{3M}{3M + 95.2}.100\% = 38,7\%$
$\Rightarrow M = 40(Ca)$
Trong $CaCO_3$, $\%Ca = \dfrac{40}{100}.100\% = 40\%$

Gọi CTTQ của A với muối cacbonat là \(A_2\left(CO_3\right)_x\)
\(\%m_A=40\%\Rightarrow\dfrac{2M_A}{2M_A+60x}=0,4\)
\(\Leftrightarrow1,2M_A=24x\Leftrightarrow M_A=20x\)
A là kim loại nên A có hóa trị I, II, III
Biện luận \(\Rightarrow\) A là Ca
CTTQ của A với muối photphat là \(A_3\left(PO_4\right)_x\)
\(\Rightarrow\%m_A=\dfrac{3.40}{3.40+95.2}.100\approx38,7\%\).