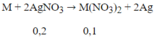Câu 1: Hỗn hợp A gồm oxit của 1 kim loại hóa trị 2 và muối cacbonat của kim loại đó được hòa tan hết bằng axit H2SO4 loãng vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được 1 lượng muối khan bằng 168% lượng A. Biết lượng khí B bằng 44% lượng A. Hỏi kim loại hóa trị 2 nói trên là nguyên tố nào? % lượng mỗi chất trong A bằng bao nhiêu.
Câu 2: Hỗn hợp gồm CaCO3...
Đọc tiếp
Câu 1: Hỗn hợp A gồm oxit của 1 kim loại hóa trị 2 và muối cacbonat của kim loại đó được hòa tan hết bằng axit H2SO4 loãng vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được 1 lượng muối khan bằng 168% lượng A. Biết lượng khí B bằng 44% lượng A. Hỏi kim loại hóa trị 2 nói trên là nguyên tố nào? % lượng mỗi chất trong A bằng bao nhiêu.
Câu 2: Hỗn hợp gồm CaCO3 và CaSO4 được hòa tan bằng axit H2SO4 vừa đủ. Sau phản ứng đun cho bay hơi bớt nước và lọc được 1 lượng kết tủa bằng 121,43% lượng hỗn hợp đầu. Tính % lượng mỗi chất trong hỗn hợp đầu.
Câu 3: Muối A tạo bởi kim loại M (hóa trị II) và phi kim X (hóa trị I). Hòa tan 1 lượng A vào nước được dung dịch A'. Nếu thêm AgNO3 dư vào A' thì lượng kết tủa tách ra bằng 188% lượng A. Nếu thêm Na2CO3 dư vào dung dịch A' thì lượng kết tủa tách ra bằng 50% lượng A. Hỏi kim loại M và phi kim X là nguyên tố nào? Công thức muối A.
Câu 4: Hỗn hợp A gồm cac kim lọi Mg, Al, Cu. Oxi hóa hoàn toàn m gam A thu được 1,72m gam hỗn hợp 3 oxit với hóa trị cao nhất của mỗi kim loại. Hòa tan m gam A bằng dung dịch HCl dư thu được 0,952 m dm3 H2(đktc). Tính % lượng mỗi kim loại trong A ( cho biết hóa trị mỗi kim loại không đổi trong 2 thí nghiệm trên ).
Câu 5: Nung nóng 1,32a gam hỗn hợp Mg(OH)2 và Fe(OH)2 trong không khí đến lượng không đổi nhận được chất rắn có khối lượng bằng a gam. Tính % lượng mỗi oxit tạo ra.
Câu 6: Cho m gam hỗn hợp Na và Fe tác dụng hết với axit HCl, dung dịch thu được cho tác dụng với bari hiđroxit dư rồi lọc kết tủa tách ra, nung trong không khí đến lượng không đổi thu được chất rắn nặng m gam. Tính % lượng mỗi kim loại ban đầu.
Gợi ý:Dạng toán khi giải quy về 100