Tính khối lượng axitsunfuric 96% thu được từ 60kg quặng Pirit sắt nếu hiệu suất quá trình là 85%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4

1) PTHH :
SO2 + Ca(OH)2 - > CaSO3 + H2O
Theo đề ta có ; nSO2 = 1,12/22,4 = 0,05 (mol)
Vì do hiệu suất pư là 80% nên => nSO2=0,04(mol)
=> nCaSO3=0,04(mol)
=> mCaSO3=4,8(mol)
tìm câu hỏi tương tự trc khi đăng chứ , bạn đăng nhiều quá làm nản lắm
tim-kiem

1.do hiệu suất nên nSO2=0,04(mol)
nCaSO3=0,04(mol)
\(\Rightarrow\) mCaSO3=4,8(mol)

\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)

Đáp án A.
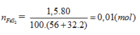
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
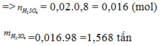

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4
x kg dd có 83,3 kg
=> x = (83,3 . 100 ) : 96 = 86,77 kg
b) Lượng S trong 80 tấn quặng pirit
(40 . 80) : 100 = 32 tấn
Điều chế H2SO4 từ S qua dãy biến hóa sau:
S -> SO2 -> SO3 -> H2SO4
32 tấn.......................98 tấn
Nếu tính theo lý thuyết ta thu đc 98 tấn H2SO4
Vậy hiệu suất của quá trình là: (92 x 100) : 98 = 93,88 %

\(m_{H_2SO_4}=10^6\cdot98\%=980000\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{980000}{98}=10000\left(mol\right)\)
Bảo toàn nguyên số S :
\(2n_{FeS_2}=n_{H_2SO_4}\Rightarrow n_{FeS_2}=\dfrac{10000}{2}=5000\left(mol\right)\)
\(\Rightarrow n_{FeS_2\left(tt\right)}=\dfrac{5000}{80\%}=6250\left(g\right)\)
\(m_{FeS_2}=6250\cdot120=750000\left(g\right)=0.75\left(tấn\right)\)
\(m_{quặng}=\dfrac{0.75}{75\%}=1\left(tấn\right)\)

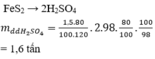
lượng axit thu được là 86.77 g
lượng axit nguyên chất là 83.3 g
số mol SO2 = SO3 = H2SO4 là 0.85 mol
số g FeS2 pư là 51g, tính theo Hiệu suất của chất tham gia pư
PTHH : 4FeS2 + 11O2 -----> 2Fe2O3 + 8SO2
2SO2 + O2 ----> 2SO3 (xt:V2O5)
SO3 + H2O -----> H2SO4