Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu trong dung dịch H2SO4 loãng, phản ứng xong thu được 6,4 gam rắn không tan. Tính thể tích khí thoát ra ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo bài ra, ta có: \(m_{Cu}=6,4\left(g\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{12-6,4}{56}=0,1\left(mol\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\)

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
____0,05<------------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6 - 2,8 = 3,2 (g)
=> D

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
_____0,05<--------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6-2,8 = 3,2 (g)
=> A

Đáp án B
Khí thi được là
![]()
Cu là kim loại đứng sau hiđro trong dãy hoạt động hóa học, do đó Cu không tác dụng với dung dịch H 2 SO 4 loãng => Chất rắn không tan là Cu
Sơ đồ phản ứng:


a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
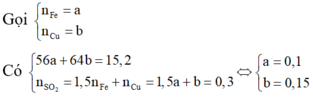
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

Khj cho B td H2SO4 ko co chat khj thoat ra chung to Al va Zn da pu het.
nCu(NO3)2=0,03=>nCu[+2]=0,03.
nAgNO3=0,01=>nAg+=0,01
goi x,y la so mol Al,Zn.
Al>Al[+3]+3e
Zn>Zn[+2]+2e
=>ne nhuog=3x+2y
Cu[+2]+2e>Cu
Ag+ + 1e>Ag
=>ne nhan=0,03.2+0,01=0,07
theo dlbt e=>3x+2y=0,07
27x+65y=1,57
=>x=0,01,y=0,02
=>nAl(NO3)3=0,01
=>mAl(NO3)3=2,13g
nZn(NO3)2=nZn[+2]=0,02=>mZn(NO3)2=3,78g
khoi luog Cu va Ag la=0,03.64+0,01.108=3g
=>kl dd giam la 3-1,57=1,43
=>kl dd luc sau la 101,43-1,43=100g
=>C%Al(NO3)3=2,13/100=2,13%
C%Zn(NO3)2=3,78%

a) Y là Cu
$m_{Cu} = 8(gam)$
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có : $27a + 56b + 8 = 13,45(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,025$
$\%m_{Cu} = \dfrac{8}{13,45}.100\% = 59,47\%$
$\%m_{Al} = \dfrac{0,15.27}{13,45}.100\% = 30,11\%$
$\%m_{Fe} = 10,42\%$
b)
$n_{H_2SO_4} = n_{H_2} = 0,25(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,25}{0,5} = 0,5(lít)$
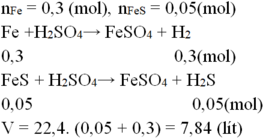
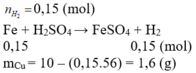
Khi cho hỗn hợp hai chất rắn gồm Fe và Cu tác dụng với dd H2SO4 loãng thì có pthh:
Fe+H2SO4\(\rightarrow\)FeSO4+H2(1)
Và vì Cu không có pư nên cr thu được sau pư chính là Cu nên:
mCu=6,4(g)theo đề bài suy ra:mFe=12-6,4=5,6(g)
nFe=5,6:56=0,1(mol)
theo pthh(1)nFe=nH2=0,1(mol)
vậy V khí H2 thoát ra:0,1\(\times\)22,4=2,24(l)