Nhúng một lá nhôm nặng 16,2g vào 512g dung dịch CUSO4, 25%. Sau một thời gian lấy lá nhôm ra khỏi dung dịch, cân lại thấy nặng 32,85g. Còn lại dung dịch A. a. Tính khôi lượng Al dã pu và khôi luợng Cu sinh ra. b. Tinh nổng độ C°o của ddA. Coi thể tích ddA ko đối. Giả sử toàn bộ lượng Cu sinh ra bám hết vào lá nhôm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(m_{tăng}=32,85-16,2=16,65\left(g\right)\\3 CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi x là số mol Al phản ứng
=> \(n_{Cu}=\dfrac{3}{2}n_{Al}=1,5x\left(mol\right)\)
Ta có: \(m_{tăng}=1,5x.64-27x=16,65\left(g\right)\)
=> \(x=\dfrac{111}{460}\left(mol\right)\)
=> \(m_{Al\left(pứ\right)}=\dfrac{111}{460}.27=6,52\left(g\right)\); \(m_{Cu}=\dfrac{111}{460}.1,5.64=23,17\left(g\right)\)
b) \(m_{ddsaupu}=6,52+512-23,17=495,35\left(g\right)\)
\(n_{CuSO_4\left(pư\right)}=\dfrac{512.25\%}{160}=0,8\left(mol\right)\)
=> \(n_{CuSO_4\left(dư\right)}=0,8-\dfrac{111}{460}.1,5=\dfrac{403}{920}\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{111}{920}\left(mol\right)\)
=> \(C\%_{CuSO_4}=14,15\%;C_{Al_2\left(SO_4\right)_3}=8,33\%\)

Đáp án B
Bảo toàn ne=> 3nAl = 2nH2=> nAl = 0,1 => %mAl = 0,1.27.100%/5 = 54%

Đáp án : C
2Al + 3Cu2+ -> 2Al3+ + 3Cu
, x -> 1,5x -> 1,5x
=> msau - mtrước = 64.1,5x – 27x = 46,38 – 45
=> x = 0,02 mol => mCu pứ = 1,5.0,02.64 = 1,92g

Chọn C
2Al + 3Cu2+ → 2Al3+ + 3Cu
x → 1,5x
Ta có ∆m = mCu – mAl ⇒ 46,38 – 45 = 64.1,5x – 27x ⇒ x = 0,02
⇒ mCu = 64.1,5.0,02 = 1,92g

Đáp án C.
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3 Cu
Gọi x là khối lượng Al phản ứng.
![]()
So với khối lượng miếng Al ban đầu thì khối lượng miếng Al sau phản ứng tăng 1,38 gam.
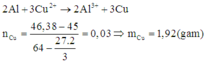
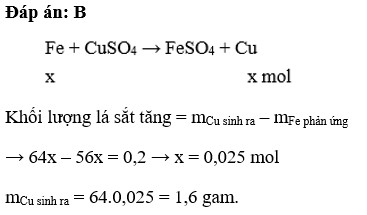
Câu này mình trả lời rồi, bạn xem ở link sau :
https://hoc24.vn/cau-hoi/nhung-mot-la-nhom-nang-162g-vao-512g-dung-dich-cuso4-25-sau-mot-thoi-gian-lay-la-nhom-ra-khoi-dung-dich-can-lai-thay-nang-3285g-con-lai-dung-dich-aa-tinh-khoi-luong-al-da-pu-va-khoi-luong-cu.1706643518303