tính số gam nước thu được khi cho 8,4 lít khí hidro tác dụng với 2,8 khí oxi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn C.
Gọi X, Y (a mol); Z (b mol) và T (c mol).
Xét phản ứng đốt cháy: ![]()
Áp dụng độ bất bão hoà, ta có: n C O 2 - n H 2 O = a - b + 3 c = - 0 , 025 ( 2 )
Xét phản ứng với dung dịch Br2, ta có: a + 2c = 0,02 (3)
Từ (1), (2) suy ra: a = 0,01; b = 0,05 và c = 0,005.
![]() (dựa vào giá trị C trung bình)
(dựa vào giá trị C trung bình)
Xét phản ứng với KOH, ta có:
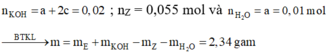

a)
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 → FeSO4 + H2
b) Gọi số mol Zn và Fe có trong 17,7 gam hỗn hợp là x và y mol. nH2 = \(\dfrac{6,72}{22,4}\)=0,3 mol
Theo tỉ lệ phản ứng ta có\(\left\{{}\begin{matrix}x+y=0,3\\65x+56y=17,7\end{matrix}\right.\)=> x = 0,1 và y = 0,2
=>%n Zn=\(\dfrac{0,1}{0,3}100=33,33\%\)
=>%n Fe=66,67%
=>m muối= 0,1.161+0,2.152=46,5g
Gọi số mol Fe, Zn là a, b (mol)
=> 56a + 65b = 17,7 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a----------------->a--->a
Zn + H2SO4 --> ZnSO4 + H2
b------------------->b----->b
=> a + b = 0,3 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%n_{Fe}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%n_{Zn}=\dfrac{0,1}{0,3}.100\%=33,33\%\end{matrix}\right.\)
mmuối = 0,2.152 + 0,1.161 = 46,5 (g)

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

CH4+2O2-to>CO2+2H2O
x---------2x-------x---------2x
C2H4+3O2-to>2CO2+2H2O
y-------------3y------2y-------2y
=>\(\left\{{}\begin{matrix}16x+28y=1,36\\2x+3y=0,16\end{matrix}\right.\)
=>x=0,05 mol , y=0,02 mol
=>%m CH4=\(\dfrac{0,05.16}{1,36}100\)=58,82%
=>%m C2H4=41,17%
=>mH2O=(0,1+0,04).18=2,52g

Khi cho hỗn hợp m vào dd H2SO4 loãng thì Cu không tác dụng => mcu=9,6 (g)
Fe + H2SO4 ------> FeSO4 + H2 (1)
Zn + H2SO4 -------> ZnSO4 + H2 (2)
Mặt khác lấy mg hỗn hợp nói trên cho tác dụng với H2SO4 đặc nguội thì có Fe không phản ứng
Zn +2H2SO4 -------> ZnSO4 + SO2 + 2H2O (3)
Cu +2H2SO4 ---------> CuSO4 + SO2 + 2H2O (4)
Ta Có mcu= 9,6 => ncu = 0,15 (mol)=nso2(4)
mà Vso2 = 7,84 (l) => nso2 = 0,35 (mol)
=> nso2 (3) =nzn= 0,35 - 0,15 = 0,2 (mol)
=> mzn = 0,2 x65 = 13 (g)
mà VH2 = 13,44 (lít) => nH2 = 0,6 (mol)
ta có nzn = nH2(2) = 0,2 (mol)
=> nH2 (1) =nFe= 0,6 - 0,2 = 0,4 (mol)
=> mFe = 0,4 x 56 = 22,4 (g)
=> m = 9,6 + 13 + 22,4 = 45 (g)
% cu = 21 %
%Fe = 50 %
% Zn = 29%

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Zn + 2HCl ---> FeCl2 + H2
0,3<---------------0,3<----0,3
=> \(\left\{{}\begin{matrix}m=0,3.65=19,5\left(g\right)\\m_{muối}=0,3.136=40,8\left(g\right)\\V_{ddHCl}:thiếu.C_M\end{matrix}\right.\)
\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
LTL: \(0,2>\dfrac{0,3}{3}\) => Fe2O3 dư
Theo pthh: nFe2O3 (pư) = \(\dfrac{1}{3}n_{H_2}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\)
nFe = \(\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\)
=> mchất rắn = 0,1.160 + 0,2.56 = 27,2 (g)

nH2 = 2.24/22.4 = 0.1 (mol)
Zn + 2HCl => ZnCl2 + H2
0.1________________0.1
mZn = 0.1 * 65 = 6.5 (g)
Zn +2HCL -> ZnCl2 +H2
nH2= 2,24/22,4=0,1 mol
nZn=nH2
mZn= 65x0,1=6,5g

2H2 + O2 -> 2H2O
nH2=0,375(mol)
nO2=0.125(mol)
Vì 0,125.2<0,375 nên H2 dư
Theo PTHH ta có:
nH2O=2nO2=0,25(mol)
mH2O=0,25.18=4,5(g)
2H2 + O2 \(\rightarrow\) 2H2O
nH2=0,375(mol)
nO2 = 0,125(mol)
(H2) \(\dfrac{0,375}{2}\)> \(\dfrac{0,125}{1}\)(O2)
=> O2 hết, H2 dư. tính theo O2
Theo pthh, ta có:
nH2O=2.nO2=0,25(mol)
=> mH2O=0,25.18=4,5(g)