Tiến hành phản ứng nhiệt nhôm m gam A gồm bột Al và oxit sắt FexOy trong điều kiện không có không khí, được hỗn hợp B. Nghiền nhỏ, trộn đều hỗn hợp B rồi chia thành 2 phần:
- Phần 1 có khối lượng 14,49 gam được hoà tan hết trong dung dịch HNO3 đun nóng thu được dung dịch C và 0.165 mol NO (sản phẩm khử duy nhất).
- Phần 2 tác dụng với lượng dư dung dịch NaOH đun nóng thấy giải phóng 0,336 lít khí H2 và còn lại 2,52 gam chất rắn.
Xác định giá trị của m và công thức của oxit sắt. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở đktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
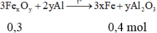
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
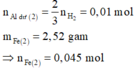
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
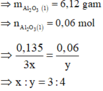
Þ Công thức oxit sắt là Fe3O4.
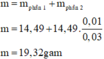

Phần 2 => mol Al = 0,01 ; mol Fe = 0,045 => ti lệ Al : Fe = 2/9
Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49
3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => mol Al = 0,01 ; mol Fe = 0,045
=> ti lệ Al : Fe = 2/9 Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49 3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => m = 19,32 2 => m = 19,32
=> Đap an B

Đáp án B
Quy đổi phần 1: thành 3 nguyên tố Al, Fe, O với số mol tương ứng là x, y, z.
27x + 56y + 16z = 14,49. (1)
Khi tác dụng với HNO3 dư thu khí NO: 0,165 mol.
Bảo toàn electron: 3x + 3y – 2z = 3nNO
3x + 3y – 2z = 3.0,165 = 0,495 (2)
Quy đổi phần 2: Al, Fe, O với số mol tương ứng là:kx, ky, kz
( Vì đề bài cho hai phần không bằng nhau)
Khi tác dụng với NaOH . Fe không phản ứng.
Bte: 3nAl – 2nO = 2nH2
3kx – 2kz = 0,03 (3)
Rắn còn lại là Fe: ky = 0,045 (4).
Lấy (3)/(4) → 3 x - 2 z y = 2 3 → 9x -2y – 6z – 0(4)
→ x = 0,15, y = 0,135, z = 0,18
Công thức oxit: y 2 = 0 , 135 0 , 18 = 3 4 → F e 3 O 4
(4) → k = 0 , 045 0 , 135 = 1 3
m d a u = m 1 + m 2 = m 1 + m 1 3 = 4 m 1 3 = 27 . 0 , 15 + 56 . 0 , 135 + 16 . 0 , 18 . 4 3 = 19 , 32 g

Phần 2:
nFe = 2,52/56=0,045 ; nAl = 2/3 nH2=0,01
=> nFe:nAl=9:2
Phần 1 :
Giả sử nFe=9x, nAl=2x
Ta có : 3nNO=3nFe+3nAl => 3(9x+2x)=3.0,165
=> x= 0,015 => nFe=0,135; nAl=0,03
=> nAl2O3=(14,49-0,135.56-0,03.27)/102=0,06
=>nFe:nO=3:4 => oxit sắt là Fe3O4
nFe: nAl2O3 = 9:4 => nAl2O3(phần 1)=0,02
=> X gồm 0,2 mol Al và 0,06 mol Fe3O4
=> m= 0,2.27+0,06.232=19,32g
=> Đáp án B

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
m = 4/3 × 14,49 = 19,32(g)

Nhiệt phân hoàn toàn X
⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol;
nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = × 14,49 = 19,32(g)
Đáp án B

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
||⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
||⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = 4 3 × 14,49 = 19,32(g)

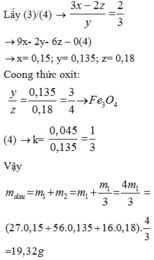
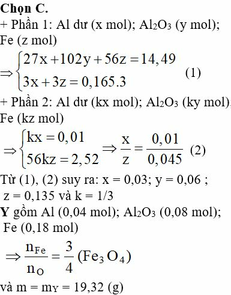

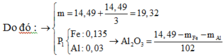
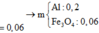
Khi cho vào NaOH có khí thoát ra chứng tỏ Al phản ứng dư. Hỗn hợp B bao gồm các chất: \(Fe,Al,Al_2O_3\)
Gọi số mol của \(Fe,Al,Al_2O_3\)trong phần 1 là: \(\left\{{}\begin{matrix}Fe:a\\Al:b\\Al_2O_3:c\end{matrix}\right.\), phần 2 là: \(\left\{{}\begin{matrix}Fe:na\\Al:nb\\Al_2O_3:nc\end{matrix}\right.\)
Phần 1:
Ta có: \(56a+27b+102c=14,49\left(1\right)\)
Quá trình nhường e:
\(Fe\left(a\right)\rightarrow Fe^{+3}+3e\left(3a\right)\)
\(Al\left(b\right)\rightarrow Al^{+3}+3e\left(3b\right)\)
Quá trình nhận e:
\(N^{+5}+3e\left(0,495\right)\rightarrow N^{+2}\left(0,165\right)\)
Theo bảo toàn e ta có:
\(3a+3b=0,495\left(2\right)\)
Phần 2:
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
\(2Al\left(0,01\right)+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\left(0,015\right)\)
\(\Rightarrow nb=0,01\left(3\right)\)
Chất rắn không tan là Fe.
\(\Rightarrow na=\dfrac{2,52}{56}=0,045\left(4\right)\)
Từ (1), (2), (3), (4) ta có hệ:
\(\left\{{}\begin{matrix}56a+27b+102c=14,49\\3a+3b=0,495\\na=0,045\\nb=0,01\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,135\\b=0,03\\c=0,06\\n=\dfrac{1}{3}\end{matrix}\right.\)
Số mol của \(Fe,Al,Al_2O_3\) có trong B là:
\(\left\{{}\begin{matrix}n_{Fe}=0,135+\dfrac{0,135}{3}=0,18\\n_{Al}=0,03+\dfrac{0,03}{3}=0,04\\n_{Al_2O_3}=0,06+\dfrac{0,06}{3}=0,08\end{matrix}\right.\)
\(\Rightarrow m=0,18.56+0,04.27+0,08.102=19,32\left(g\right)\)
Số mol của Fe và O có trong hỗn hợp ban đầu là:
\(\left\{{}\begin{matrix}n_{Fe}=0,18\\n_O=3.0,08=0,24\end{matrix}\right.\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,18}{0,24}=\dfrac{3}{4}\)
Vậy oxit cần tìm là: \(Fe_3O_4\)
Đối với dạng bài mà cho hỗn hợp KL và oxit Kl phản ứng với axit thì thường giải bằng PP quy đổi và PP bảo toàn e.
Quy đổi hỗn hợp Al và FexOy thành Al, Fe, O.
Gọi số mol trong phần 1 của Al, Fe, O lần lượt là x, y, z.
Phần 1 có khối lượng 14,49g.
=> 27x + 56y +16z = 14,49 (1)
Áp dụng BT e
Al -> Al3+ + 3e
x....................3x
Fe -> Fe3+ +3e
y..................3y
O + 2e -> O2-
z.....2z
N+5 +3e -> N+2(NO)
0,495...0,165
Vì ne nhường = ne nhận
<=> 3x+3y = 2z+0,495 (2)
Phần 2 tác dụng với NaOH dư thấy có 0,336 lít H2 và 2,52 g chất rắn dư
Gọi a là tỉ lệ khối lượng giữa phần 2/phần 1 => \(a=\dfrac{m_{phần2}}{m_{phần1}}=\dfrac{n_2}{n_1}\)
=> nAl = nH2/1,5 = 0,01 mol = a.x (3) (viết PTHH ra thì sẽ thấy rõ)
mFe + mO = 2,52 => a.56y + a.16z = 2,52 (4)
Ta có hệ 4 pt (1), (2), (3), (4)
27x + 56y +16z = 14,49 (1)
3x+3y = 2z+0,495 (2)
a.x = 0,01 (3)
a.56y + a.16z = 2,52 (4)
Chia (4)/(3) \(\Rightarrow\dfrac{56y+16z}{x}=\dfrac{2,52}{0,01}\left(5\right)\)
Giải hệ (1), (2), (5)
(Cô giải ra mol bị lẻ \(x\approx0,0519;y\approx0,1975;z\approx0,1267\))
@Trần Hữu Tuyển @Hung nguyen @Nguyễn Thị Kiều @Hồ Hữu Phước
Các em xem lại xem cô sai ở đâu, cô ko phát hiện ra