Cho 30,4 gam hỗn hợp gồm FeO và FexOy theo tỉ lệ mol 1:1 hòa tan trong HNO3 dư sau phản ứng thu được 4,48 lít khí NO2 duy nhất ở điều kiện tiêu chuẩn. Tìm FexOy
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Gọi $n_{Al} = a ; n_{Fe} = b$
$\Rightarrow 27a + 56b = 12,55(1)$
$n_{NO_2} = 0,75(mol)$
Bảo toàn electron :
$3n_{Al} + 3n_{Fe} = n_{NO_2} \Rightarrow 3a + 3b = 0,75(2)$
Từ (1)(2) suy ra a = 0,05 ; b = 0,2
$m_{Al} = 0,05.27 = 1,35(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$n_{HNO_3} = 2n_{NO_2} = 0,75.2 = 1,5(mol)$

Đáp án C.
MY = 18,8 Y chứa NO (3y) và H2 (2y) X chứa H+ và NO3- dư.
nNO = 0,26 mol
Bảo toàn khối lượng:
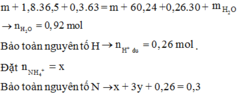
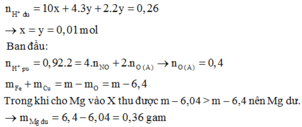
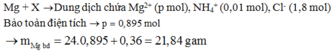

Gọi: nFe = nCu = x (mol)
⇒ 56x + 64x = 12 ⇒ x = 0,1 (mol)
Gọi: \(\left\{{}\begin{matrix}n_{NO}=a\left(mol\right)\\n_{NO_2}=b\left(mol\right)\end{matrix}\right.\)
BT e, có: 3nFe + 2nCu = 3nNO + nNO2
⇒ 3a + 2b = 0,5 (1)
Mà: Tỉ khối của X với H2 là 19.
\(\Rightarrow\dfrac{30a+46b}{a+b}=19.2\left(2\right)\)
Từ (1) và (2) ⇒ a = b = 0,1 (mol)
\(\Rightarrow V_{hh}=\left(0,1+0,1\right).22,4=4,48\left(l\right)\)


