R là kim loại hóa trị 2 . Hòa tan 2 gam oxot của R vào 48 gam dung dịch H2SO4 6,125% loãng , thu được dung dịch A trong đó nồng độ H2SO4 chỉ còn 0.98%
a, viết PTHH và xác định R (biết RSO4 là muối tan )
b, tính thể tích dung dịch NaOH 8% (d=1,05g/mol) cần cho vào A để thu được lượng kết tủa lớn nhất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(R_2O_3+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(m_{H_2SO_4}=168.35\%=58,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
Theo PT: \(n_{R_2O_3}=\dfrac{1}{3}n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow M_{R_2O_3}=\dfrac{32}{0,2}=160=2M_R+16.3\Rightarrow M_R=56\left(g/mol\right)\)
→ R là Fe.
b, Ta có: m dd sau pư = mFe2O3 + m dd H2SO4 = 32 + 168 = 200 (g)
Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,2.400}{200}.100\%=40\%\)
c, Ta có: \(n_{Fe_2\left(SO_4\right)_3.10H_2O}=n_{Fe_2\left(SO_4\right)_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3.10H_2O}=0,2.580=116\left(g\right)\)

Phân tử khối của mỗi chất là: M = 1,875.32 = 60
Gọi CTPT là CxHyOz
+ z = 1: 12x + y = 44
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 44-12x ≤ 2x+2 => 3 ≤ x < 3,67 => x = 3
CTPT là C3H8O
+ z = 2: 12x + y = 28
Do 0 < H ≤ 2C + 2 => 0 < y ≤ 2x+2 => 0 < 28-12x ≤ 2x+2 => 1,857 ≤ x < 2,33 => x = 2
CTPT là C2H4O2
- Do X, Y, Z đều có khả năng phản ứng với Na nên có chứa nhóm –OH hoặc –COOH.
- Y tác dụng với dung dịch NaHCO3 nên Y là hợp chất axit. Công thức phân tử của Y là C2H4O2. Công thức cấu tạo của Y là CH3COOH.
- Khi oxi hóa X tạo X1 có khả năng tham gia phản ứng tráng gương nên X là ancol bậc 1. Công thức phân tử của X là C3H8O. Công thức cấu tạo của X là: CH3-CH2-CH2-OH.
- Chất Z có khả năng tham gia phản ứng tráng gương nên Z có chứa nhóm chức –CHO. Công thức phân tử của Z là C2H4O2. Công thức cấu tạo của Z là HO-CH2-CHO.
Chú ý:
+ Tác dụng với Na thì trong phân tử có nhóm – OH hoặc –COOH
+ Có phản ứng tráng bạc => trong phân tử có nhóm –CHO

\(n_{H2\left(dktc\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_R=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\left(dvc\right)\)
Vậy kim loại R là nhôm
b) \(2Al+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(n_{SO2}=\dfrac{0,3.3}{2}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
a) PTHH: \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_R=0,2\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{5,4}{0,2}=27\) \(\Rightarrow\) R là Nhôm (Al)
b) PTHH: \(2Al+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Theo PTHH: \(n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,3\cdot22,4=6,72\left(l\right)\)



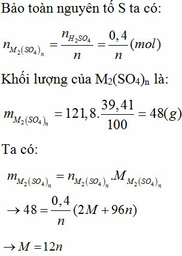

a. R là kim loại hóa trị II => oxit của R có công thức là RO.
\(n_{H2SO4}=\dfrac{48\times6,125\%}{98}0,03mol\)
PTHH: RO + H2SO4 -> RSO4 + H2O
Khối lượng dung dịch sau phản ứng là mddsau=mRO + mH2SO4=50g
nH2SO4dư = \(\dfrac{0,98\%.50}{98}=0,005mol\)
=> nRO = nH2SO4pứ = 0,03-0,005 = 0,025mol
=> MRO = 2/0,025 = 80 => MR= 64 => R là Cu.
b. Sau phản ứng còn H2SO4 dư. Để thu được lượng kết tủa lớn nhất thì dung dịch NaOH cho vào phải trung hòa hết axit và kết tủa hết muối CuSO4.
H2SO4 + 2NaOH -> Na2SO4 + H2O
0,005...........0,01
CuSO4 + 2NaOH -> Cu(OH)2\(\downarrow\) + Na2SO4
0,025..........0,05
=> nNaOH =0,06mol.
=> mddNaOH 8% = \(\dfrac{mNaOH}{8\%}=\dfrac{0,06.40}{8\%}=30g\)
=> VddNaOH 8% =\(\dfrac{m_{ddNaOH-8\%}}{1,08}=\dfrac{30}{1,05}=28,95ml\)