Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a/ PTHH: R + 2HCl ===> RCl2 + H2
nH2 = 2,688 / 22,4 = 0,12 (mol)
nR = nH2 = 0,12 mol
=> MR = 6,72 / 0,12 = 56 (g/mol)
=> R là Fe

PTHH: R + 2HCl ---> RCl2 + H2 (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{100}{1000}.5=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
Vậy HCl dư.
Theo PT(1): \(n_R=n_{H_2}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{4,8}{0,2}=24\left(g\right)\)
Vậy R là magie (Mg)
PT: Mg + 2HCl ---> MgCl2 + H2 (2)
Ta có: \(m_{dd_{MgCl_2}}=4,8+\dfrac{100}{1000}-0,2.2=4,5\left(lít\right)\)
Theo PT(2): \(n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,2}{4,5}=\dfrac{2}{45}M\)

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
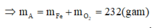
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
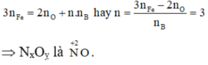
Khi đó:
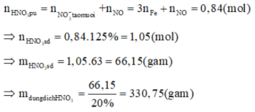

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
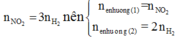
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
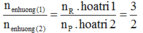
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
![]()
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
![]()
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
![]()
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:

Þ NxOỵ là .
Khi đó
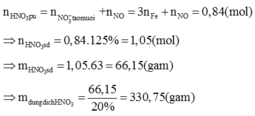

- Giả sử khối lượng dung dịch axit là 100 g .
=> nH2SO4 = 0,05 ( mol )
\(R_2O_n+nH_2SO_4\rightarrow R_2\left(SO_4\right)_n+nH_2O\)
.0,05/n......0,05.............0,05/n.......0,05.............
=> mddsau = \(100+\dfrac{0,05}{n}\left(2R+16n\right)=100,8+\dfrac{R}{10n}\left(g\right)\)
=> \(5,882\%=\dfrac{\dfrac{0,05}{n}\left(2R+96n\right)}{100,8+\dfrac{R}{10n}}.100\%\)
=> \(R=11,99617501n\)
Lập bảng giá trị ta được : ( R; n ) = ( ~24; 2 ) TM .
Vậy công thức oxit là MgO .

a) \(n_{H_2}=\dfrac{0,8}{2}=0,4\left(mol\right)\)
PTHH: 2A + H2SO4 --> A2SO4 + H2
0,8<-------------------------0,4
=> \(M_A=\dfrac{18,4}{0,8}=23\left(Na\right)\)
b)
PTHH: 2Na + H2SO4 --> Na2SO4 + H2
0,4<--------0,4<----0,4
=> \(C_{M\left(ddH_2SO_4\right)}=\dfrac{0,4}{0,5}=0,8M\)
\(C_{M\left(ddNa_2SO_4\right)}=\dfrac{0,4}{0,5}=0,8M\)


a. R là kim loại hóa trị II => oxit của R có công thức là RO.
\(n_{H2SO4}=\dfrac{48\times6,125\%}{98}0,03mol\)
PTHH: RO + H2SO4 -> RSO4 + H2O
Khối lượng dung dịch sau phản ứng là mddsau=mRO + mH2SO4=50g
nH2SO4dư = \(\dfrac{0,98\%.50}{98}=0,005mol\)
=> nRO = nH2SO4pứ = 0,03-0,005 = 0,025mol
=> MRO = 2/0,025 = 80 => MR= 64 => R là Cu.
b. Sau phản ứng còn H2SO4 dư. Để thu được lượng kết tủa lớn nhất thì dung dịch NaOH cho vào phải trung hòa hết axit và kết tủa hết muối CuSO4.
H2SO4 + 2NaOH -> Na2SO4 + H2O
0,005...........0,01
CuSO4 + 2NaOH -> Cu(OH)2\(\downarrow\) + Na2SO4
0,025..........0,05
=> nNaOH =0,06mol.
=> mddNaOH 8% = \(\dfrac{mNaOH}{8\%}=\dfrac{0,06.40}{8\%}=30g\)
=> VddNaOH 8% =\(\dfrac{m_{ddNaOH-8\%}}{1,08}=\dfrac{30}{1,05}=28,95ml\)