Cho m gam hỗn hợp X gồm Al, MgO, MgSO4 tân hoàn toàn trong 163,68 gam dung dịch H2SO4 28,74%, sau phản ứng thu được dung dịch Y có chứa H2SO4 4,9% và 6,048 lít H2 (đktc). Lấy 120 gam dung dịch Y cho tác dụng với dung dịch NaOH dư thu được kết tủa Z và dung dịch T. Lọc lấy kết tủa Z và nung đến khối lượng không đổi thu được a gam chất rắn. Sục khí CO2 đến dư vào dung dịch T thu được 9,36 gam kết tủa. Xác định giá trị m, a và phần trăm khối lượng các chất trong hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam

Đây là một câu khá khó trong đề thi chính thức của BGD, khó ở chỗ đề khá dài và nhiều phản ứng nối tiếp nhau.Tuy nhiên nếu bình tĩnh thì các bạn sẽ dễ dàng giải được bài toán này.
+ Tính các dữ liệu đã biết:

+ Sục khí CO2 dư vào Y, thu được 7,8 gam kết tủa, đó chính là Al(OH)3:
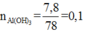
+ Thật cẩn thận và bình tĩnh để phân tích từng chi tiết của bài toán:
Cho X và NaOH dư, thu được H2 ⇒ Al dư, đồng nghĩa với việc oxit sắt là phản ứng hết.
Vậy X gồm A12O3, Al dư và Fe. Chất không tan Z là Fe.
+ Khi đã xác định được các chất X, Y, Z rồi thì chúng ta sẽ hệ thống và tóm tắt lại bài toán:
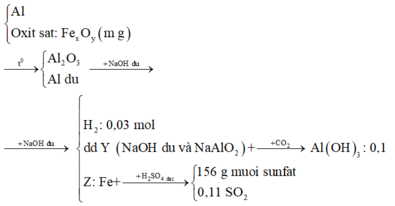
+ Sau khi đã tóm gọn được các dự liệu của bài toán, ta tiếp tục khai thác:
Từ 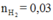 mol ⇒ Al dư
mol ⇒ Al dư
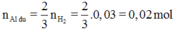
Có thể viết ra phương trình 2A1 + 2NaOH + 2H2O ⟶2NaAlO2 + 3H2
+ Vì tất cả Al đều đi vào kết tủa dưới dạng Al(OH)3 nên áp dụng định luật bảo toàn nguyên tố Al ta được:
![]()
⇒nAl phản ứng = 0,1 - 0,02 = 0,08 mol ⇒ n Al 2 O 3 = 0 , 04 mol
Vì oxit sắt phản ứng hết, Al dư nên lượng O có trong oxit sắt đã cùng với Al phản ứng đi hết vào trong Al2O3, do đó ta suy ra được
![]()
+ Vì đề bài chỉ hỏi m là khối lượng của oxit sắt (bao gồm sắt và oxi), ta đã tính được số mol oxi rồi nên bây giờ ta chỉ cần tìm khối lượng của sắt trong oxit, chú ý là toàn bộ lượng sắt trong oxit đều chuyển về Fe đơn chất (Z) nên ta sẽ khai thác ý sai của đề bài:
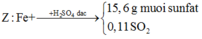
+ Ở đây có 2 cách giải để tìm số mol Fe:
Cách 1: Ta không thể biết được 15,6 gam muối sunfat đó là muối sắt II hay sắt III nên hướng giải tự nhiên là ta đặt ẩn phụ để giải:
Đặt
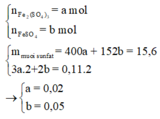
Chú ý là ta đã áp dụng phương pháp bảo toàn số mol electron:
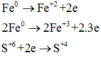
Do đó tổng số mol Fe là nFe = 2a + b = 0,09 mol
Vậy m = mFe +mO =0,09.56 + 0,12.16 = 6,96 gam.
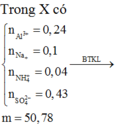
Cách 2: Ta chỉ cần tìm số mol Fe nên có thể dùng ngay công thức giải nhanh sau:
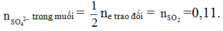
Mà 15,6 gam muối sunfat bao gồm ion những ion gì của sắt và định lượng của những ion này như thế nào ta không cần quan tâm:
![]()
Do đó: m = mFe + mO = 5,04 + 0,12.16 = 6,96 gam
Đáp án D
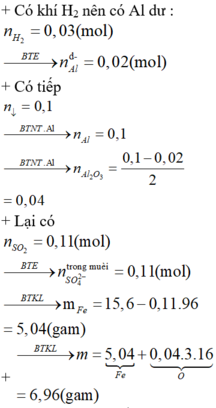


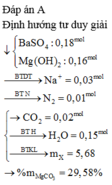
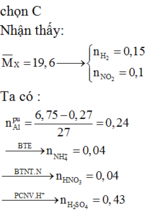
Trường hợp 2: phản ứng tạo ra 2 loại muối
SO2 + MOH \(\rightarrow\) MHSO3
x mol x mol
SO2 + 2MOH \(\rightarrow\) M2SO3 + H2O
y mol 2y mol y mol
nSO2 < nNaOH < 2nSO2 => 0,2 < a < 0,4
Ta có hệ phương trình: x+ y= nSO2 và x+ 2y =nMOH
=> y= nMOH - nSO2 = 0,4 - a= nH2O sinh ra
Theo định luật bảo toàn khối lượng:
mSO2 + mNaOH + mKOH = m chất tan + mH2O sinh ra
64.a+0,3.40+0,1.56 = 30,08 + 18.(0,4-a)
=> a= 0,24 ( thỏa mãn) => V= 5,376 lít
Xét phản ứng giữa hỗn hợp A với H2SO4 đặc
R2SO3 + H2SO4 \(\rightarrow\)R2SO4 + SO2 + H2O
2RHSO3 + H2SO4 \(\rightarrow\)R2SO4 + 2SO2+ H2O
Từ 2 phương trình trên ta thấy: nhỗn hợp A = nSO2= 0,24
Tính được M ( trung bình) của hỗn hợp A bằng 115
=> R + 81 < 115 < 2R + 80
=> 17,5 < R < 43
=> R là Na (M = 23)
Xét phản ứng giữa Na với dd HCl:
nNa= 0,5 mol; nHCl = 0,4 mol
Nadư + HClhết \(\rightarrow\) NaCl + H2O
0,4 mol 0,4 mol 0,4 mol
nNadư = 0,5-0,4 = 0,1 mol
2Na + 2H2O \(\rightarrow\) 2NaOH + H2
0,1 mol 0,1 mol
Dung dịch Y chứa: 0,4 mol NaCl và 0,1 mol NaOH
NaCl + AgNO3 \(\rightarrow\) AgCl + NaNO3
0,4 mol 0,4 mol
NaOH + AgNO3\(\rightarrow\)AgOH+ NaNO3
0,1 0,1
2AgOH\(\rightarrow\)Ag2O + H2O
0,1 0,05
Kết tủa thu được gồm 0,4 mol AgCl và 0,05 mol Ag2O có tổng khối lượng là 69 gam
- PTHH: 2Al + 3H2SO4 \(\rightarrow\) Al2 (SO4)3 + 3H2 (1)
MgO + H2SO4 \(\rightarrow\) MgSO4 + 2HO (2)
2NaOH+ H2SO4 \(\rightarrow\) Na2SO4 + 2H2O (3)
2NaOH+ MgSO4 \(\rightarrow\) Mg(OH)2 + Na2SO4 (4)
6NaOH+ Al2(SO4)3\(\rightarrow\) 3Na2SO4 + 2Al(OH)3 (5)
NaOH + Al(OH)3 \(\rightarrow\) NaAlO2 + 2H2O (6)
Mg(OH)2 \(\rightarrow\) MgO + H2O (7)
CO2 + NaOH \(\rightarrow\) NaHCO3 (8)
CO2 + NaAlO2 + 2H2O \(\rightarrow\) Al(OH)3 + NaHCO3 (9)
nH2SO4= \(\dfrac{163,68.28,74}{100.98}\)= 0,48 mol
Ta có: nH2 = \(\dfrac{6,048}{22,4}\)= 0,27 mol
Theo (1): nAl= \(\dfrac{2}{3}\)0,27 = 0,18 mol
- Ta coi dung dịch Y có 2 phần: + Phần 1 là dd Y ban đầu
+ Phần 2 là dd Y có khối lượng 100g
Kết tủa T là Al(OH)3 có số mol = 9,36/37 = 0,12 mol
Gọi k là tỉ số giữa phần 1 và phần 2
Suy ra k= 0,18/0,12= 1,5
\(\Rightarrow\) \(\dfrac{m+163,68-0,54}{120}\)= 1,5
\(\Rightarrow\) m= 16,86 (gam)
- Ở phần 1: mol axit dư= (16,86 + 163,68 - 0,54). 4,9/(100.98)= 0,09 mol
\(\rightarrow\) mol axit pư với MgO= mol MgO = 0,48-0,27-0,09 = 0,12 mol
Vậy phần trăm về khối lượng từng chất trong hỗn hợp ban đầu là:
%mAl = \(\dfrac{0,18.27}{16,86}\)100% = 28,82%
%mMgO= \(\dfrac{0,12.40}{16,86}\)100%= 28,47%
%mMgSO4 = 100% - 28,82% - 28,47% = 42,71%
Tìm x: Tổng mol MgSO4 trong dd Y ban đầu là
nMgSO4 = nMgO + nMgSO4 (bd)
= 0,12 + (16,9860 - 4,86- 4,8) : 120 = 0,18 mol
Do: nMgSO4 (p1) = 1,5n MgSO4 (p2)
Ở phần 1 của dung dịch Y:
\(\Rightarrow\)MgSO4 (p2) = \(\dfrac{0,18}{1,5}\)= 0,12 mol
Theo PT (4,7)
a=mMgO = 0,12.40 = 4,8 gam
nNaOH= 0,3 mol; nKOH= 0,1 mol
Xết pư giữa a mol SO2 với dd chứa 0,3 mol NaOH và 0,1 mol KOH ( quy về MOH: 0,4 mol)
+ Trường hợp 1: MOH dư
SO2 + 2MOH \(\rightarrow\)M2SO3 + H2O
a 2a a
nH2O sinh ra= a mol và 2a < 0,4 => a <0,2
Theo ĐLBTKL:
mSO2 + mNaOH + mKOH = m chất tan + mH2O sinh ra
64.a+ 0,3.40 + 0,1.56 = 30,08 + a.18
=> a= 0,27 ( vô lý)