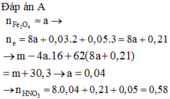oxi hóa 10,08g Fe dc m(g) chất rắn gồm 4 chất. cho hỗn hợp rắn tác dụng với HNO3 dư dc 2,24l NO. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


C là Fe2O3
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
=> nFe = 0,2 (mol)
=> mFe = 0,2.56 = 11,2 (g)

Chọn B
mO = 28,168 – 18,536 = 9,632g ⇒ nO = 0,602 ⇒ ne = 1,204
⇒ m = 18,536 + 62.1,204 = 93,184

Đáp án A
Fe + Cu2+ → Fe2+ + Cu; Fe + 2Ag+ → Fe2+ + 2Ag; 2Fe3+ + Fe → 3Fe2+.

Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)

PTHH: \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(\Rightarrow n_{Al}=0,09\left(mol\right)\) \(\Rightarrow\%m_{Al}=\dfrac{0,04\cdot27}{2,6}\cdot100\%\approx41,54\%\)
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+64b=2,6-0,04\cdot27=1,52\) (1)
Mặt khác: \(n_{NO}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,075\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Fe}=0,022\left(mol\right)\\b=n_{Cu}=0,0045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,022\cdot56}{2,6}\cdot100\%\approx47,38\%\\\%m_{Cu}\approx11,08\%\end{matrix}\right.\)