cho 3,6g hỗn hợp gồm kali và môt kim loại kiềm A tác dụng vừa hết vs nước cho 2,24 lít H2 (ở 0,5atm và 0oC)
a) khối lượng ngtu A lớn hay nhỏ hơn K
b) Biết số mol kim loại A trong hỗn hợp lớn hơn 10% tổng số mol 2 kim loại vậy A lf nguyên tố nào
c) Xđ m từng chất trong hh ban đầu và sản phẩm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

0,5atm và 0oC hình như là 44,8 lít đó.
Tính số mol H2 = 0,05 (mol )
Gọi M là KLTB của hai kim loại
\(M_A< \overline{M}< M_B\)
\(\overline{M}+H_2O\rightarrow\overline{M}OH+\dfrac{1}{2}H_2\uparrow\)
0,1 <-----------------------0,05
\(M_{\overline{M}}=\dfrac{3,6}{0,1}=36\)
=> \(M_A< 36< M_K\) (1)
Vậy khối lượng ngtử A < Kali
b) Theo gt: \(n_A>0,1.10\%=0,01\)
=> \(n_K< 0,09\)
=> \(m_K< 0,09.39=3,51\)
\(M_A>\dfrac{3,6-3,51}{0,01}=9\) (2)
(1)(2) \(\Rightarrow\) A là Natri
c) \(\left\{{}\begin{matrix}39x+23y=3,6\\0,5x+0,5y=0,05\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08125\\y=0,01875\end{matrix}\right.\)
\(m_K=39.0,08125=3,16875\left(g\right)\)
\(m_{Na}=0,01875.23=0,43125\left(g\right)\)
sản phẩm tự thế số vô tính đi nha
Bài này mol hơi xấu nhỉ, nếu lấy TH kim loại A là Li thì mol sẽ đẹp

n H2 = 1,12/22,4 = 0,05(mol)
Gọi n K = a(mol) ; n X = b(mol)
$2K + 2H_2O \to 2KOH + H_2$
$2X + 2H_2O \to 2XOH + H_2$
n K + n X= a + b = 2n H2 = 0,1(mol)
=> n X = b > 0,1.10% = 0,01
Suy ra : 0,01 < b < 0,1
Ta có : 39a + Xb = 3,6
<=> 39(0,1 - b) + Xb = 3,6
<=> Xb - 39b = -0,3
<=> X = (-0,3 + 39b)/b
Với 0,01 < b < 0,1 thì 29 < X < 38
Vậy X không có giá trị X thỏa mãn
(Sai đề)

Gọi kim loại cần tìm là M. gọi số mol của K là x(mol), số mol của M là y(mol).
PT: K+ H2O ---> 1/2KOH + H2
M + H2O ----> MOH + 1/2 H2
dựa vào số mol khí thu được, ta có pt :
0.5(x+y)= 0.05 <=> x+y = 0.1
dựa vào khối lượng của hai chất ta có pt
39x+ My=3.6 (*)
mà y>10% tổng số mol tức là y>0.01
giờ ta dùng phương pháp chặn
giá trị nhỏ nhất của y là 0.01.=> x=0.09 thay x, y vào (*) => M=9.
giá trị lớn nhất của y là 0.1 => x=0, thay x,y vào (*) => M=36.
vậy ta có 9<M<36, mà M là kim loại kiềm, vậy M là Na(23).
Chúc em học tốt!!

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2K + 2H2O → 2KOH + H2
Mol: x 0,5x
PTHH: 2M + 2H2O → 2MOH + H2
Mol: y 0,5y
TH1: x=10%(x+y) ⇒ 9x=y
Ta có hệ pt:
\(\left\{{}\begin{matrix}39x+M_M.y=3,6\\0,5x+0,5y=0,05\\9x=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}39x+M_M.y=3,6\\x+9x=0,1\\9x=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}M_M=\dfrac{3,6-39.0,01}{0,09}=35,7\left(g/mol\right)\\x=0,01\\y=0,09\end{matrix}\right.\left(loại\right)\)
TH2: y=10%(x+y) ⇒ 9y=x
Ta có hệ pt:
\(\left\{{}\begin{matrix}39x+M_M.y=3,6\\0,5x+0,5y=0,05\\9y=x\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}39x+M_M.y=3,6\\9y+y=0,1\\9y=x\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}M_M=\dfrac{3,6-39.0,09}{0,01}=9\left(g/mol\right)\\y=0,01\\x=0,09\end{matrix}\right.\left(loại\right)\)

1.
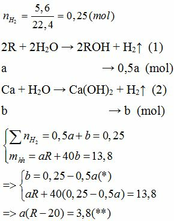
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
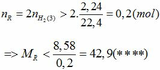
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
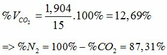
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
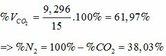




Đề bài : n(H2)=2,24.0,50,082.273=0,05n(H2)=2,24.0,50,082.273=0,05 (mol) => M(tb hh) = 3,60,1=363,60,1=36 => A là Na hoặc Li . Vì n(A) > 10% tổng số mol 2 KL tức n(A) > 0,01 => A chỉ có thể là Na
32/ cho 12,2 g hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl,thu được 2,24lit khí (đktc) .Khối lượng muối tạo ra sau phản ứng là??
=>Do hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp .Dùng tăng giảm khối lượng : m(muối) = 12,2 + 1,1 = 13,3 (g)
Đề bài : n(H2)=2,24.0,50:082.273=0,05(mol)
=> M(tb hh) = 3,6:0,1=36 => A là Na hoặc Li . Vì n(A) > 10% tổng số mol 2 KL tức n(A) > 0,01 => A chỉ có thể là Na
32/ cho 12,2 g hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl,thu được 2,24lit khí (đktc) .Khối lượng muối tạo ra sau phản ứng là??
=>Do hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp .Dùng tăng giảm khối lượng : m(muối) = 12,2 + 1,1 = 13,3 (g)