Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2K + 2H2O → 2KOH + H2
Mol: x 0,5x
PTHH: 2M + 2H2O → 2MOH + H2
Mol: y 0,5y
TH1: x=10%(x+y) ⇒ 9x=y
Ta có hệ pt:
\(\left\{{}\begin{matrix}39x+M_M.y=3,6\\0,5x+0,5y=0,05\\9x=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}39x+M_M.y=3,6\\x+9x=0,1\\9x=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}M_M=\dfrac{3,6-39.0,01}{0,09}=35,7\left(g/mol\right)\\x=0,01\\y=0,09\end{matrix}\right.\left(loại\right)\)
TH2: y=10%(x+y) ⇒ 9y=x
Ta có hệ pt:
\(\left\{{}\begin{matrix}39x+M_M.y=3,6\\0,5x+0,5y=0,05\\9y=x\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}39x+M_M.y=3,6\\9y+y=0,1\\9y=x\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}M_M=\dfrac{3,6-39.0,09}{0,01}=9\left(g/mol\right)\\y=0,01\\x=0,09\end{matrix}\right.\left(loại\right)\)

0,5atm và 0oC hình như là 44,8 lít đó.
Tính số mol H2 = 0,05 (mol )
Gọi M là KLTB của hai kim loại
\(M_A< \overline{M}< M_B\)
\(\overline{M}+H_2O\rightarrow\overline{M}OH+\dfrac{1}{2}H_2\uparrow\)
0,1 <-----------------------0,05
\(M_{\overline{M}}=\dfrac{3,6}{0,1}=36\)
=> \(M_A< 36< M_K\) (1)
Vậy khối lượng ngtử A < Kali
b) Theo gt: \(n_A>0,1.10\%=0,01\)
=> \(n_K< 0,09\)
=> \(m_K< 0,09.39=3,51\)
\(M_A>\dfrac{3,6-3,51}{0,01}=9\) (2)
(1)(2) \(\Rightarrow\) A là Natri
c) \(\left\{{}\begin{matrix}39x+23y=3,6\\0,5x+0,5y=0,05\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08125\\y=0,01875\end{matrix}\right.\)
\(m_K=39.0,08125=3,16875\left(g\right)\)
\(m_{Na}=0,01875.23=0,43125\left(g\right)\)
sản phẩm tự thế số vô tính đi nha
Bài này mol hơi xấu nhỉ, nếu lấy TH kim loại A là Li thì mol sẽ đẹp

Đề bài : n(H2)=2,24.0,50,082.273=0,05n(H2)=2,24.0,50,082.273=0,05 (mol) => M(tb hh) = 3,60,1=363,60,1=36 => A là Na hoặc Li . Vì n(A) > 10% tổng số mol 2 KL tức n(A) > 0,01 => A chỉ có thể là Na
32/ cho 12,2 g hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl,thu được 2,24lit khí (đktc) .Khối lượng muối tạo ra sau phản ứng là??
=>Do hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp .Dùng tăng giảm khối lượng : m(muối) = 12,2 + 1,1 = 13,3 (g)
Đề bài : n(H2)=2,24.0,50:082.273=0,05(mol)
=> M(tb hh) = 3,6:0,1=36 => A là Na hoặc Li . Vì n(A) > 10% tổng số mol 2 KL tức n(A) > 0,01 => A chỉ có thể là Na
32/ cho 12,2 g hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl,thu được 2,24lit khí (đktc) .Khối lượng muối tạo ra sau phản ứng là??
=>Do hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp .Dùng tăng giảm khối lượng : m(muối) = 12,2 + 1,1 = 13,3 (g)

1.
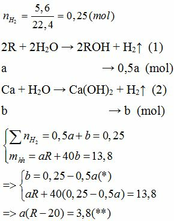
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
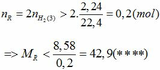
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
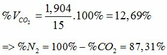
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
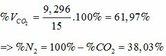

Gọi A là công thức cung của 2 KL
\(n_{H_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
_____0,25<----------------------0,125_____(mol)
=> \(M_A=\dfrac{7,83}{0,25}=31,32\left(g/mol\right)\)
Mà 2 KL ở 2 chu kì liên tiếp
=> 2 kim loại đó là Na(23) và K(39)

a, Đặt kim loại trung bình là R \(\rightarrow \) R hóa trị II
\(PTHH:R+2HCl\to RCl_2+H_2\\ \Rightarrow n_R=n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ \Rightarrow M_R=\dfrac{6,5}{0,2}=32,5(g/mol)\)
Vậy 2 KL đó là Mg (24) và Ca (40)
\(b,\) Đặt \((n_{Mg};n_{Ca})=(x;y)(mol)\)
\(\Rightarrow \begin{cases} 24x+40y=6,5\\ x+y=n_{H_2}=0,2 \end{cases}\Rightarrow \begin{cases} x=0,09375(mol)\\ y=0,10625(mol) \end{cases}\\ \Rightarrow \begin{cases} m_{Mg}=2,25(g)\\ m_{Ca}=4,25(g) \end{cases}\)

Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\) \(\Rightarrow n_R=0,3\left(mol\right)\)
\(\Rightarrow\overline{M}_R=\dfrac{8,5}{0,3}\approx28,33\left(đvC\right)\), mà 2 kim loại thuộc 2 chu kì liên tiếp
\(\Rightarrow\) 2 Kim loại cần tìm là Natri và Kali
Đặt \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\dfrac{1}{2}a+\dfrac{1}{2}b=0,15\left(mol\right)\)
Ta lập được HPT:
\(\left\{{}\begin{matrix}23a+39b=8,5\\\dfrac{1}{2}a+\dfrac{1}{2}b=0,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,2\cdot23=4,6\left(g\right)\\m_K=0,1\cdot39=3,9\left(g\right)\end{matrix}\right.\)

\(n_{HCl}=0.2\cdot2=0.4\left(mol\right)\)
\(BTKL:\)
\(m_{hh}+m_{HCl}=m_M+m_{H_2}\)
\(\Rightarrow m_M=8+0.4\cdot36.5-0.2\cdot2=22.2\left(g\right)\)
\(n_{Fe}=n_M=a\left(mol\right)\)
\(\Rightarrow a\left(56+M\right)=8\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(\Rightarrow a+\dfrac{an}{2}=0.2\)
\(\Rightarrow a\left(1+\dfrac{n}{2}\right)=0.2\left(2\right)\)
\(\dfrac{\left(1\right)}{\left(2\right)}=\dfrac{a\left(56+M\right)}{a\left(1+\dfrac{n}{2}\right)}=\dfrac{8}{0.2}=40\)
\(\Rightarrow56+M=40\left(1+\dfrac{n}{2}\right)\)
\(\Rightarrow56+M=40+20n\)
\(\Rightarrow M-20n+16=0\)
\(BL:\)
\(n=2\Rightarrow M=24\)
\(M:Mg\)
\(\)
Gọi kim loại cần tìm là M. gọi số mol của K là x(mol), số mol của M là y(mol).
PT: K+ H2O ---> 1/2KOH + H2
M + H2O ----> MOH + 1/2 H2
dựa vào số mol khí thu được, ta có pt :
0.5(x+y)= 0.05 <=> x+y = 0.1
dựa vào khối lượng của hai chất ta có pt
39x+ My=3.6 (*)
mà y>10% tổng số mol tức là y>0.01
giờ ta dùng phương pháp chặn
giá trị nhỏ nhất của y là 0.01.=> x=0.09 thay x, y vào (*) => M=9.
giá trị lớn nhất của y là 0.1 => x=0, thay x,y vào (*) => M=36.
vậy ta có 9<M<36, mà M là kim loại kiềm, vậy M là Na(23).
Chúc em học tốt!!
sao bạn gọi tớ là em
dù sao vẫn thanks bạn nha