Ngâm 1 lá Zn trong 100ml dd AgNO3 0,1M. Sau đó lấy thanh Zn ra rồi cho tiếp dd HCl vào dd vừa thu được thì không thấy hiên tượng. Hỏi khối lượng Zn tăng hay giảm sao với ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Vì khi cho HCl vào dung dịch vừa thu được không thấy hiện tượng gì nên trong dung dịch không còn Ag+
![]()
Do đó Ag+ đã phản ứng hết với Zn.
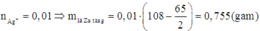

Bai 1
\(n_{H_2}=0,12\left(mol\right)\\\)
Áp dụng DLBTKL ta có
\(m_{dd\left(spu\right)}=m_N+m_{ddHCl\left(bd\right)}-o,12\cdot2\\ \Rightarrow m_{tang}=m_N-0,12\cdot2=6,48\\ \Leftrightarrow a=m_N=6,72\left(g\right)\)
Gọi hóa trị của N là x
\(2N+2xHCl\rightarrow2NCl_x+xH_2\)
\(m_N=M_N\cdot\dfrac{0,24}{x}=6,72\\ \Rightarrow M_N=28x\)
Lập bảng xét các giá trị của x tìm được N la sat (Fe)
\(n_{Zn\left(pu\right)}=0,1\left(mol\right)\\ \\ Zn+2HCl\rightarrow ZnCl_2+H_2\\\)
Theo PTHH
\(V_{H_2\left(dktc\right)}=0,1\cdot22,4=2,24\left(l\right)\\ m_{HCl}=0,2\cdot36,5=7,3\left(mol\right)\)
\(m_{dd\left(spu\right)}=m_{ddHCl\left(bd\right)}+6,5-0,1\cdot2=m_{ddHCl\left(bd\right)}+6,3\left(g\right)\)
Vậy sau phản ứng dung dịch HCl tăng khối lượng thêm 6,3 gam

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

a)\(m_{AgNO3}bd=\frac{250.4}{100}=10g\)
\(m_{AgNO3}pu=\frac{10.17}{100}=1,7g\)
\(n_{AgNO3}pu=\frac{m}{M}=\frac{1,7}{170}=0,01\left(mol\right)\)
PTHH:
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\downarrow\)
0,005 0,01 0,005 0,01 (mol)
\(m_{thanhCu}spu=m_{thanhCu}bd+m_{Ag\downarrow}-m_{Cu}pu=5+0,01.108+0,005.64=5,76g\)

\(a)\)
\(PTHH: Zn +2AgNO_3 ---> Zn(NO_3)_2 + 2Ag \)
\(nZn = \dfrac{0,65}{65}=0,01(mol)\)
\(nAgNO_3 = 0,1.0,1 = 0,01 (mol)\)
So sánh: \(\dfrac{nZn}{1}=0,01>\dfrac{nAgNO_3}{2} = 0,005\)
=> \(Zn\) dư sau phản ứng, Chọn \(nAgNO_3\) để tính
Theo PTHH: \(nZn \) đã phản ứng \(=0,005(mol)\)
\(=> mZn \)\(= 0,005.65 = 0,325 (g)\)
\(b)\)
Theo PTHH: \(nAg = 0,01 (mol)\)
=> \(mAg = 0,01.108 = 1,08 (g)\)
mZn dư = mZn - mZn phản ứng \(= 0,65 - 0,325 = 0,325 (g)\)
Khi cho Zn tác dụng với AgNO3 thì thanh Zn tan ra kim loại màu bạc là Ag bám lên thanh Zn
=> thanh Zn sau khi lấy ra gồm có Zn dư sau phản ứng và lượng Ag bám lên (được tạo thành sau phản ứng)
\(<=> m = mZn (dư) + mAg \)
\(<=> m = 0,325 + 1,08 = 1,405 (g)\)
Vậy \(m=1,405 (g)\)

Ta có:
Zn + Cu(NO3)2 \(\rightarrow\) Zn(NO3)2 + Cu (1)
0,3 0,3 mol 0,3 mol
Zn + Pb(NO3)2 \(\rightarrow\) Zn(NO3)2 + Pb (2)
0,1 0,1 mol 0,1 mol
Khối lượng lá kẽm sẽ = 100 g - 65.0,4 + 64.0,3 + 207.0,1 = 113,9 gam.

2Na + 2H2O -> 2NaOH + H2 (1)
2K + 2H2O -> 2KOH + H2 (2)
nNa=0,2(mol)
nK=0,1(mol)
Từ 1 và 2:
nH2=\(\dfrac{1}{2}\)nNa,K=0,15(mol)
VH2 lí thuyết=0,15.22,4=3,36(lít)
VH2 thực tế=3,36.95%=3,192(lít)
Bài 4:
Số mol O2 là:
nO2 = V/22,4 = 14/22,4 = 0,625 (mol)
Tỉ lệ: nH2 : nO2 = 1/2 : 0,625/1 = 0,5 : 0,625
=> O2 dư, tính theo H2
PTHH: 2H2 + O2 -> 2H2O
---------1-------0,5----1-----
Vì hiệu suất phản ứng là 90% nên số mol H2O thu được sau phản ứng là:
nH2O(spư) = 90%.nH2O(đb) = 90%.1 = 0,9 (mol)
Khối lượng H2O thu được là:
mH2O = n(spư).M = 0,9.18 = 16,2 (g)
Vậy ...

Vì cho HCl vào dd mà ko thấy hiện tượng gì nên AgNO3 đã PƯ hết với Zn,mà Ag nặng hơn Zn nên thanh Zn tăng so với ban đầu