Cho 4.15 gam hỗn hợp Fe,Al tác dụng với 200 ml CuSO4 0.525M. Đến phản ứng xảy ra hoàn toàn lọc kết tủa A gồm 2 kim loại có khối lượng là 7.84 g,dd nước lọc. Tìm số mol của kim loại trong hỗn hợp đầu và trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
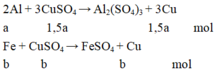
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

Định hướng tư duy giải
Ta có:
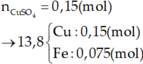
Dễ thấy 6 gam rắn là Fe2O3
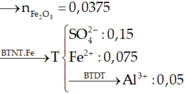
Có Al dư → Phần X phản ứng:
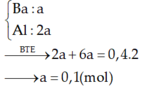
Chú ý: Vì chất tan thu được là Ba(AlO2)2→ tỷ lệ mol Ba : Al phải là 1 : 2
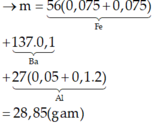

Đáp án C
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
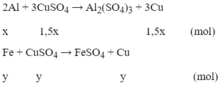
Ta có:
27x + 56(y + z) = 4,15 (1)
3x/2 + y = 0,280.525 = 0,105 (mol) (2)
64(1,5x + y) + 56y = 7,84 (3)
Phản ứng:
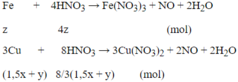
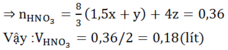




Ta có 200ml = 0,2 lít
=> nCuSO4 = 0,2 . 0,525 = 0,105 ( mol )
Fe hoạt động yếu hơn Al nên 2 KL thu được là Cu và Fe dư . ( Khả năng Fe phản ứng một phần )
Gọi x, y, z là số mol lần lượt của Fephản ứng , Al, Fedư
mà mhỗn hợp = 4,15 ( gam )
=> 56x + 27y + 56z = 4,15 ( * )
Fe + CuSO4 → FeSO4 + Cu
x → x → x → x
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
y → 1,5y → 0,5y → 1,5y
Từ hai phương trình trên
=> Hai chất rắn sau phản ứng là Cu và Fedư
=> 64x + 96y + 56z = 7,84 ( ** )
mà x + 1,5y = 0,105 ( *** )
=> \(\left\{{}\begin{matrix}\text{56x + 27y + 56z = 4,15 }\\\text{64x + 96y + 56z = 7,84}\\\text{x + 1,5y = 0,105}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,03\\y=0,05\\z=0,02\end{matrix}\right.\)
=> nFe ban đầu = 0,03 + 0,02 = 0,05 ( mol )
=> nCu ban đầu = 0,05 ( mol )
Để biết chứng minh Fe dư ta làm như sau:
Giả sử Fe dư, suy ra CuSO4 phản ứng hết \(\Rightarrow n_{Cu\left(tạo-thành\right)}=0,105mol\)
\(\Rightarrow m_{KL}=0,105.64=6,72\left(g\right)< 7,84\left(g\right)\)
Suy ra kim loại Fe dư