Cho dung dịch chứa 8, 19 gam muối NaX tác dụng một lượng dư dung dịch AgNO3 thu được 20,09 gam kết tủa,
a. Tìm nguyên tử khối và gọi tên X
b. X có hai đồng vị , giả sử số nguyên tử của đồng vị thứ nhất nhiều gấp 3 lần số nguyên tử của đồng vị thứ hai. Hạt nhân của đồng vị thứ nhất có ít hơn hạt nhân đồng vị thứ hai 2 nơtron. Tìm số khối của mỗi đồng vị
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
AgNO3 + NaX = AgX + NaNO3
nAgX = nNaX => 20,09/(108 + X) = 8,19/(23 + X) => X = 35,5 (Cl)
Vậy X là chlorine
b.
Gọi A1 và A2 lần lượt là số khối của mỗi đồng vị
Số nguyên tử A1 nhiều hơn A2 là 50%, dễ dàng tính được phần trăm của A1 và A2 lần lượt là 60% và 40%
(giải hệ x = y + 0,5y và x + y = 100)
Ta có : N2 - N1 = 2 => (A2 - Z) - (A1 - Z) = 2 => A2 - A1 = 2 (1)
A(Cl) = 35,5 => 60A1 + 40A2 = 100.35,5 (2)
Từ (1)(2) => A1 ≈ 35 và A2 ≈ 37
* Trên thực tế, nguyên tố Cl có 2 đồng vị bền là Cl35 chiếm 75,77% và Cl37 chiếm 24,23%

a> Phương trình phản ứng:
NaX + AgNO3 \(\rightarrow\) NaNO3 + AgX
12,285g a mol a mol 30,135g
Áp dụng ĐL BTKL ta có: 12,285 + 170.a = 85.a + 30,135
Giải pt thu được: a = 0,21 mol.
Từ khối lượng của NaX, ta có: (23 + X).0,21 = 12,285 suy ra: nguyên tử khối trung bình của X là: X = 35,5 đvc.
X là Clo.
b) Clo có hai đồng vị là: 35Cl và 37Cl thỏa mãn yêu cầu bài toán. (Vì 35Cl chiếm 75,77% nên 37Cl sẽ chiếm 24,23% về nguyên tử).
Trong phân tử HClOn, phần trăm khối lượng của 35Cl là 26,39% nên ta có: 35*0,7577/(1 + 0,7577.35 + 0,2423.37 + 16n) = 0,2639. (Lưu ý Cl trong HClOn có cả 2 đồng vị của Clo).
Giải pt thu được n = 4.
Công thức cần tìm: HClO4.

Đáp án B
Có phản ứng:
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:
n N a X = n A g X = 14 , 35 - 5 , 85 85 0 , 1 ( m o l )
⇒ M N a X = 5 , 85 0 , 1 = 58 , 5 ⇒ 23 + X = 58 , 5 ⇔ X = 35 , 5
⇒ x 1 + x 2 = 100 35 x 1 + 37 x 2 100 = 35 , 5 ⇔ x 1 = 75 x 2 = 25

Có phản ứng:
![]()
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:

Đáp án B

Đáp án D
TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a a
Áp dụng pp tăng giảm khối lượng ![]()
→ a = 0,03 (mol) → MNaZ= 201→ Z = 178
X và Y là I (127) và At (210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06 0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
%NaF = ![]() .100% = 41,8%
.100% = 41,8%

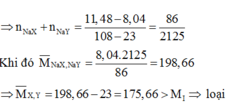

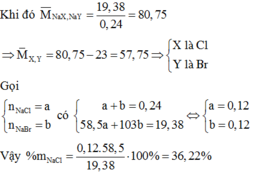
NaX + AgNO3 ---> AgX + NaNO3
x mol -----------------x mol.
ta có: 108x - 23x = 20,09 - 8,19 => x = 0,14 mol
=> 23 + X = 8,19 : 0,14 = 58,5 => X = 35,5 là Clo.
hai đồng vì là 1735Cl và 1737Cl