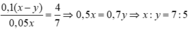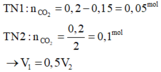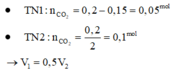cho từ từ 100ml dung dịch Hcl 0.5M vào 150ml dung dich hỗn hợp Na2Co3 0.2M và HaHCO3 0.1M thì thu được bao nhiêu lít CO2?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Dung dịch X gồm $K^+,CO_3^{2-} , HCO_3^-$
Gọi $n_{CO_3^{2-}\ pư} = a(mol) ; n_{HCO_3^-\ pư} = b(mol)$
Ta có :
$a + b = \dfrac{2,688}{22,4} = 0,12$
$2a + b = n_{HCl} = 0,15$
Suy ra a = 0,03 ; b = 0,09
Trong X, gọi $n_{CO_3^{2-}} = m(mol) ; n_{HCO_3^-} = n(mol)$
Ta có :
$\dfrac{m}{n} = \dfrac{a}{b} = \dfrac{0,03}{0,09} = \dfrac{1}{3}$
Bảo toàn C : $m + n = \dfrac{39,4}{197} = 0,2$
Suy ra m = 0,05 ; n = 0,15
200 ml dung dịch X gồm $0,1(mol)\ CO_3^{2-} ; 0,3(mol)\ HCO_3^-$
Bảo toàn C : $0,2 + x = 0,1 + 0,3 \Rightarrow y = 0,2$
Bảo toàn Kali : $x + 0,2.2 = 0,1.2 + 0,3 \Rightarrow x = 0,1$

https://tuhoc365.vn/qa/tron-100-ml-dung-dich-a-gom-khco3-1m-va-k2co3-1m-vao-100-ml-dung-dich-b-gom-nahco3-1m-va-na2co3-1m-t/

Chọn đáp án B
Chú ý : Khi cho HCl vào C O 3 2 - thì
![]()
Nhưng khi cho C O 3 2 - vào HCl thì
![]()
+ Ta có :
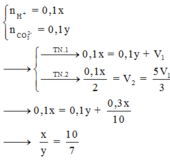

Chọn đáp án B
Bảo toàn C ta có: n C O 3 2 - + n H C O 3 - = n C a C O 3 = 0,25 mol
X + HCl → C O 2
n C O 2 = n C O 3 2 - + n H C O 3 - = 0,25 mol
=> V = 0,25.22,4 = 5,6 lít

+ Tính các giá trị đã biết:
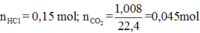
+ Với bài toán tổng hợp như này, thì ta phải viết các phương trình cụ thể cho dễ quan sát:
(1) H+ + CO3- ⟶ HCO3-
(2) H+ + HCO3- ⟶ CO2 +H2O.
Vì thu được khí CO2 nên có xảy ra phản ứng (2) ⇒ CO32- đã phản ứng hết với H+.
+ Từ
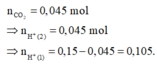
+ Vì khi thêm dung dịch Ba(OH)2 vào dung dịch Y thu được kết tủa nên trong Y phải có muối HCO3-
Như vậy suy ra ngay HCl đã phản ứng hết
Do đó từ (1) và (2) ta suy ra
![]()
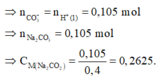
Loại ngay các đáp án A và B.
Việc cần thực hiện bây giờ là đi tính nồng độ của KHCO3 trong dung dịch X:
Vậy dung dịch Y chỉ chứa các ion K+, Na+, HCO3- và Cl-.
+ Khi thêm dịch Ba(OH)2 dư vào dung dịch Y thì:
![]()
Sau đó thì
![]()
+ Do đó 29,55 gam kết tủa là BaCO3:
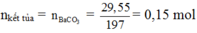
Ta sử dụng Bảo toàn nguyên tố C, toàn bộ C trong dung dịch Y chuyển hóa hết về trong kết tủa (vì thêm dung dịch Ba(OH)2 dư vào):
![]()
+ Lại áp dụng bảo toàn nguyên tốC ta được:
![]()
Hay ![]()
![]()
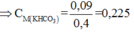
Đáp án D

Đáp án C
Trường hợp 1: Khi nhỏ từ từ axit vào dung dịch muối cacbonat, phản ứng xảy ra theo trình từ
H+ + CO32- → HCO3-
Sau đó H+còn dư + HCO3- → CO2 + H2O
=> nCO2 = nH+ – nCO32- = 0,1(x – y)
Trường hợp 2: Khi nhỏ từ từ muối cacbonat vào axit thì phản ứng tạo ra ngay CO2:
2H+ + CO32- → CO2 + H2O
nCO2 = ½ nH+ = 0,05x
Do V1 : V2 = 4 : 7