GIẢI GẤP GIÙM MÌNH VỚI
cho 32 g hỗn hợp gồm kim loại Ba và kim loại kiềm R tác dụng hết với nước thu được dung dịch A và 6.72 lít H2.
a, cần dùng bao nhiêu ml dung dịch HCl 0.5M để trung hòa 1/10 dung dịch A
b, cô cạn 1/10 dung dịch A thu được bao nhiêu gam chất rắn khan
c, lấy 1/10 dung dịch A rồi cho thêm 99ml dung dịch Na2SO4 0.2M thấy trong dung dịch vẫn còn hợp chất của Ba nhưng nếu thêm tiếp 4 ml dung dịch Na2SO4 cùng nồng độ trên thì thấy dư Na2SO4. Xác định kim loại R

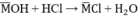
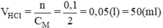



\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Gọi \(\overline{M}\) là khối lượng hỗn hợp
ta có: \(M_A< \overline{M}< M_B\)
Pt: \(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(R+2H_2O\rightarrow R\left(OH\right)_2+H_2\)
\(\overline{M}=\dfrac{32}{0,3}=106,67\)
mà \(M_A< \overline{M}< M_B\)
\(\Rightarrow M_R< 106,67< 137\)
R là Kali
--------
Uầy không biết đúng không, nhìn sai sai /_/
tại sao M=32/0.3 vậy