Cho 5,6 gam Fe phản ứng với 100 ml dd HCl 3M. Tính khối lượng chất dư sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Fe+HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=3n_{Fe}=0,3\left(mol\right)\)
\(\dfrac{0,1}{1}< \dfrac{0,3}{2}\rightarrow HCl\) dư
\(n_{HCl}=0,3-0,1.2=0,1\left(mol\right)\)
\(n_{FeCl_2}=n_{HCl}=0,1\left(mol\right)\)
\(m_{HCl}=0,1.36,5=3,65\left(g\right)\)
\(m_{FeCl_2}=0,1.127=12,7\left(g\right)\)

nFe = 0,1 mol
nHCl = 0,3 mol
Fe + 2HCl ---> FeCl2 + H2
0,1 < 0,3/2 .....=> HCl dư sau phản ứng
nFeCl2 = 0,1 mol => CM = 0,1/0,2 = 0,5M
nHCl(dư) = 0,1 mol => CM = 0,1/0,2 = 0,5M
a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=0,2\cdot1,5=0,3\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\) \(\Rightarrow\) Fe p/ứ hết, HCl còn dư
\(\Rightarrow n_{HCl\left(dư\right)}=0,1\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=0,1\cdot36,5=3,65\left(g\right)\)
c) Theo PTHH: \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)=n_{HCl\left(dư\right)}\)
\(\Rightarrow C_{M_{FeCl_2}}=C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

nFe = 5.6/56 = 0.1 (mol)
nHCl = 0.2*2 = 0.4 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
LTL : 0.1/1 < 0.4/2 => HCl dư
mHCl dư = ( 0.4 - 0.2 ) * 36.5 = 7.3 (g)
VH2 = 0.2*22.4 = 4.48 (l)
CM FeCl2 = 0.1/0.2 = 0.5(M)
CM HCl dư = 0.2 / 0.2 = 1(M)

Fe + 2HCl -> FeCl2 + H2
nFe = 5,6/56 = 0,1 mol
=>nH2 = 0,1 mol
=> VH2= 0,1*22,4= 2,24 lít
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,1-->0,2------------------>0,1
=> \(\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,2.36,5}{15\%}=\dfrac{146}{3}\left(g\right)\\V_{H_2}=0,1.22,4=4,48\left(l\right)\end{matrix}\right.\)

mCu = 2 (g)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 10,3 - 2 = 8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{10,3}.100\%=26,21\%\\\%Fe=\dfrac{0,1.56}{10,3}.100\%=54,37\%\\\%Cu=\dfrac{2}{10,3}.100\%=19,42\%\end{matrix}\right.\)
\(n_{HCl}=2.n_{H_2}=0,5\left(mol\right)\)
=> \(V_{dd.HCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)

\(a,n_{HCl}=0,1.1=0,1\left(mol\right)\\ n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
LTL: \(0,1>\dfrac{0,1}{2}\) => Fe dư
Theo pthh: \(n_{H_2}=n_{FeCl_2}=n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
=> VH2 = 0,05.22,4 = 1,12 (l)
b, Chất dư là Fe
mFe (dư) = (0,1 - 0,05).56 = 2,8 (g)
c, \(C_{M\left(FeCl_2\right)}=\dfrac{0,05}{0,1}=0,5M\)
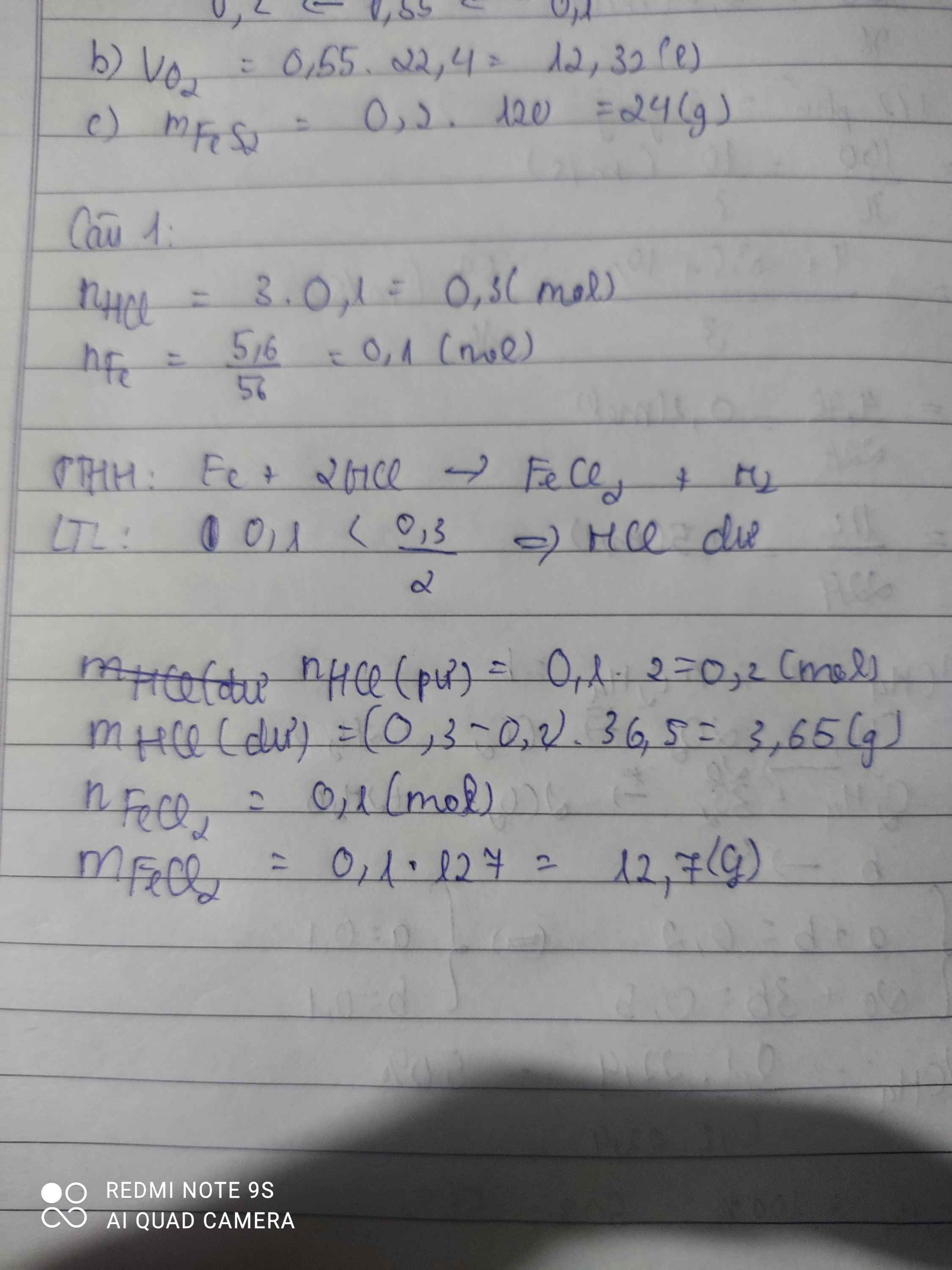
nHCl=0,1.3=0,3(mol)
nFe=5,6/56=0,1(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
Ta có: 0,3/2 > 0,1/1
=> Fe hết, HCl dư => Tính theo nFe
=> nHCl(dư)= 0,3 - 2.0,1=0,1(mol)
=>mHCl(dư)=36,5.0,1=3,65(g)
\(n_{Fe}=0,1\left(mol\right)\)
\(n_{HCl}=3.0,1=0,3\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\Rightarrow\) HCl dư.
\(\Rightarrow n_{HCl\text{ pư}}=2n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\text{ dư}}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{HCl\text{ dư}}=0,1.36,5=3,65\left(g\right)\)