cho 5,6 lít CO2 (đktc) đi qua 164 ml đ NaOH20% (d=1,22 g/ml) thu được dd X. Cô cạn dd X thì thu được bao nhiêu gam chất rắn ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(V_{NaOH}=164ml\)
Áp dụng ct V = m / D
\(\Rightarrow m_{ddNaOH}=V.D=164.1,22=200,08\left(g\right)\)
\(\Rightarrow m_{NaOH}=\dfrac{200,08.20\%}{100\%}=40,016\left(g\right)\)
\(\Rightarrow n_{NaOH}=\dfrac{40,016}{40}=1,0004\left(mol\right)\)
\(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
0,25----> 0,5 --------> 0,25------>0,25 (mol)
\(m_{Na_2SO_3}=0,25.126=31,5\left(g\right)\)
\(m_{NaOH}=\left(1,0004-0,5\right).40=20,016\left(g\right)\)
Thu được : \(31,5+20,016=51,516\left(g\right)\) rắn

Bài 1:
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\n_{NaOH}=\dfrac{164\cdot1,22\cdot20\%}{40}=1,0004\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Vì NaOH dư nên tính theo CO2 \(\Rightarrow\left\{{}\begin{matrix}n_{Na_2CO_3}=0,25\left(mol\right)\\n_{NaOH\left(dư\right)}=0,5004\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na_2CO_3\left(rắn\right)}=0,25\cdot106=26,5\left(g\right)\\m_{NaOH\left(rắn\right)}=0,5004\cdot40=20,016\left(g\right)\end{matrix}\right.\)
*Các bài còn lại bạn làm theo gợi ý bên dưới
PTHH: \(CO_2+NaOH\rightarrow NaHCO_3\) (1)
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\) (2)

Đáp án D
mNaOH = mdD.C% = 1,22.164.20% = 40g nNaOH = 1; nCO2 = 0,25
Do nNaOH/nCO2 = 4 Tạo muối trung hòa
CO2 + 2NaOH → Na2CO3 + H2O
0,25 → 0,5 → 0,25
mrắn = mNa2CO3 + mNaOH dư = 0,25.106 + 0,5.40 = 46,5g Chọn D.
Cho 12,24 gam BaO vào 300 ml dd HCl 0,2M thu được dung dịch X. Cô cạn X được bao nhiêu gam chất rắn?

\(n_{BaO}=\dfrac{12,24}{153}=0,08\left(mol\right);n_{HCl}=0,3.0,2=0,06\left(mol\right)\)
PTHH: BaO + 2HCl → BaCl2 + H2O
Mol: 0,03 0,06 0,03
Ta có: \(\dfrac{0,08}{1}>\dfrac{0,06}{2}\) ⇒ BaO dư, HCl pứ hết
\(m_{BaCl_2}=0,0,3.208=6,24\left(g\right)\)
\(m_{BaOdư}=\left(0,08-0,03\right).153=7,65\left(g\right)\)
⇒ mchất rắn = 6,24+7,65 = 13,89 (g)

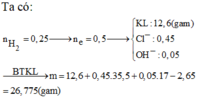
* Nếu trong TN2, kim loại không tan hết
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
=> nHCl = 0,04 (mol)
- Xét TN1:
- Nếu kim loại tan hết
\(n_{FeCl_2}=\dfrac{3,1}{127}=\dfrac{31}{1270}\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
\(\dfrac{31}{1270}\)<-\(\dfrac{31}{635}\)<----\(\dfrac{31}{1270}\)
Vô lí do \(\dfrac{31}{635}>0,04\)
=> Fe dư
PTHH: Fe + 2HCl --> FeCl2 + H2
0,02<-0,04---->0,02
=> \(m_{FeCl_2}=0,02.127=2,54\left(g\right)\)
=> \(m_{Fe\left(dư\right)}=3,1-2,54=0,56\left(g\right)\)
=> \(a=0,56+0,02.56=1,68\left(g\right)\)
- Xét TN2:
Theo ĐLBTKL: a + b + 0,04.36,5 = 3,34 + 0,02.2
=> a + b = = 1,92 (g)
=> b = 0,24 (g)
\(n_{Mg}=\dfrac{0,24}{24}=0,01\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,01-------------->0,01-->0,01
Fe + 2HCl --> FeCl2 + H2
0,01<-------------0,01<--0,01
=> \(\left\{{}\begin{matrix}m_{MgCl_2}=0,01.95=0,95\left(g\right)\\m_{FeCl_2}=0,01.127=1,27\left(g\right)\end{matrix}\right.\)
* Nếu trong TH2, kim loại tan hết
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
PTHH: Mg + 2HCl --> MgCl2 + H2
x----------------->x------>x
Fe + 2HCl --> FeCl2 + H2
y----------------->y---->y
=> \(\left\{{}\begin{matrix}95x+127y=3,34\\x+y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=-0,025\\y=0,045\end{matrix}\right.\) (vô lí)


Ta có pthh
CO2 + 2NaOH \(\rightarrow\) H2O + Na2CO3
Theo đề bài ta có
nCO2=\(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
mddNaOH=D.V = 164.1,22=200,08 g
-> mct=mNaOH=\(\dfrac{m\text{dd}.C\%}{100\%}=\dfrac{200,08.20\%}{100\%}\approx40\left(g\right)\)
->nNaOH=\(\dfrac{40}{40}=1\left(mol\right)\)
Theo pthh
nCO2=\(\dfrac{0,25}{1}mol< nNaOH=\dfrac{0,5}{2}mol\)
-> Số mol của NaOH dư ( tính theo số mol của CO2)
Dung Dịch X thu được sau phản ứng bao gồm NaOH dư và Na2CO3
Theo pthh
nNaOH = 2nCO2=2.0,25=0,5 mol
-> mNaOH=(1-0,5).40=20 g
nNa2CO3=nCO2=0,25 mol
-> mNa2CO3=0,25.108=27g
Ta có :\(n_{CO_2}\)= \(0,25mol\)
\(m_{ddNaOH}\)=\(164.1,22\) = 200g
Từ đó :
\(m_{NaOH}=\)\(200.\dfrac{20}{100}=40g\)
\(\Rightarrow\)\(n_{NaOH}=\dfrac{40}{40}=1mol\)
Phương trình hoá học :CO\(_2\)+2NaOH\(\rightarrow\)Na2C\(O_3\)+H\(_2\)O
theo bài ra 0,25mol 1mol
thep pt 1mol 2mol
Vì \(\dfrac{0,25}{1}< \dfrac{1}{2}\) nên NaOH dư , tính theo CO\(_2\)
\(\Rightarrow n_{NaOH}=0,25mol\)
Cô cạn dung dịch được Na\(_2\)C\(O_3\) khan có m =106.0.25 =26.5 g