1-Thêm dần dung dịch KOH 33,6% vào 40,3 ml dung dịch HNO3 37,8%(d = 1,24g/ml) tới trung hoà hoàn toàn thu được dung dịch A. Đưa A về 00C được dung dịch có nồng độ 11,6% và m gam muối tách ra.
a) Tính m. b) Dung dịch B đã bão hoà chưa?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
mdd của HNO3= 1,24.40,3=50 gam
=> mHNO3 = \(\dfrac{50.37,8}{100}=18,9gam\) ( đây là khối lượng chất tan HNO3)
=> \(n_{HNO_3}=\dfrac{18,9}{63}=0,3mol\)
theo PTHH => \(n_{KOH}=0,3mol\)
=> \(m_{KOH}=0,3.56=16,8gam\)
=> khối lượng dung dịch KOH tham gia phản ứng:
\(\dfrac{16,8}{33,6}.100=50gam\)
=> Tổng khối lượng dung dịch sau phản ứng là
50 + 50 =100 gam dung dịch
Theo PTHH=> \(n_{KNO_3}=0,3mol=>m_{KNO_3}=0,3.101=30,3gam\)
Khi hạ nhiệt độ của dung dịch về 00C thì thu được dd có nồng độ 11,6 % nên ta có:
\(\dfrac{30,3-m}{100-m}.100\%=11,6\%\)
Giải phương trình trên ta nhận được m=21,15 gam
vậy m= 21,15 gam
b) Dung dịch B là dung dịch đã bão hòa !
a) \(n_{HNO_3}=\dfrac{37,8\left(40,3\cdot1,24\right)}{100\cdot63}=0,3\left(mol\right)\)
KOH + HNO3 \(\rightarrow\)KNO3 + H2O
0,3-----0,3----------0,3
\(m_{ddKOH}=\dfrac{56\cdot0,3\cdot100}{33,6}=50\left(g\right)\)
\(m_{ddHNO_3}=40,3\cdot1,24=50\left(g\right)\)
\(m_{KNO_3}=0,3\cdot101=30,3\left(g\right)\)
Dựa vào đề bài ta có phương trình :
\(\dfrac{30,3-m}{\left(50+50\right)-m}=\dfrac{11,6}{100}\Rightarrow m=21,15\left(g\right)\)
b) Dung dịch B là dung dịch bão hòa ở 0oC

Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2
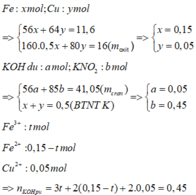


Hoà tan hoàn toàn hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X (NaOH dư,NaAlO2)
Chú ý thứ tự các phản ứng khi thêm dung dịch HCl vào dung dịch X
HCl + NaOH → NaCl + H2O (1)
NaAlO2+ HCl+ H2O → NaCl + Al(OH)3 (2)
Al(OH)3 + 3HCl → AlCl3 + 3H2O (3)
Khi thêm 0,1 mol HCl thì bắt đầu xuất hiện kết tủa → nNaOH dư = 0,1 mol (xảy ra (1))
Khi thêm 0,2 mol HCl thì xảy ra (1), (2) ( lượng AlO2- trong pt (2)dư )
→ nkết tủa = nH+ phản ứng (2) = 0,2 - 0,1 = 0,1 mol → a = 7,8 gam. Loại B,D
Khi thêm 0,6 mol HCl xảy ra hiện tượng hòa tan kết tủa (xảy ra cả 3 phương trình)
→ 4×nAlO2- = 3nkết tủa + (nH+ -0,1) → nAlO2- = 0,2 mol
Vậy NaAlO2 0,2 mol, NaOH dư 0,1 mol → m= mAl2O3 + mNa2O = 0,1×102 + 0,15×62 = 19,5 gam
Đáp án A
Đáp án:
21,15(gam)21,15(gam)
Giải thích các bước giải:
mdung dịch HNO3=D.V=1,24.40,3=50(gam)mdung dịch HNO3=D.V=1,24.40,3=50(gam)
⇒nHNO3=50.37,8%63=0,3(mol)⇒nHNO3=50.37,8%63=0,3(mol)
HNO3+KOH→KNO3+H2OHNO3+KOH→KNO3+H2O
Theo PTHH :
nKNO3=nKOH=nHNO3=0,3(mol)nKNO3=nKOH=nHNO3=0,3(mol)
⇒mdd KOH=0,3.5633,6%=50(gam)⇒mdd KOH=0,3.5633,6%=50(gam)
Muối tách ra là KNO3KNO3
Gọi nKNO3(tách ra)=x(mol)nKNO3(tách ra)=x(mol)
Sau khi tách muối :
nKNO3=0,3−x(mol)nKNO3=0,3−x(mol)
mdd=mdd KOH+mdd HNO3−mKNO3(bị tách)mdd=mdd KOH+mdd HNO3−mKNO3(bị tách)
=50+50−101x=100−101x(gam)=50+50−101x=100−101x(gam)
⇒C%KNO3=(0,3−x).101100−101x.100%=11,6%⇒C%KNO3=(0,3−x).101100−101x.100%=11,6%
⇒x=0,2094(mol)⇒x=0,2094(mol)
Suy ra : m=0,2094.101=21,15(gam)