Cho biết oxit của một kim loại có tỉ lệ phần trăm về khối lượng của oxi chiếm 47,06%. Biết trong phân tử gồm 5 nguyên tử tạo thành hãy xác định và gọi tên oxit.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)Gọi CTHH của oxit là \(R_xO_y\).
Trong phân tử có 5 nguyên tử tạo thành.
\(\Rightarrow x+y=5\left(1\right)\)
Theo bài: \(\%m_O=\dfrac{16y}{R\cdot a+16y}\cdot100\%=47,06\%\)
\(\Rightarrow\left\{{}\begin{matrix}a=2\\b=3\\R=27\Rightarrow Al\end{matrix}\right.\)
Vậy CTHH là \(Al_2O_3\) có tên nhôm oxit.
b)\(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05mol\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1 0,05
\(m_{Al\left(OH\right)_3}=0,1\cdot78=7,8g\)
\(H=80\%\Rightarrow m_{Al\left(OH\right)_3}=7,8\cdot80\%=6,24g\)
a) Đặt CTHH của oxit là NxOy
Theo đề bài ta có : x + y = 5(1)
Mà : %O=\(\dfrac{16y}{Nx+16y}100=47,06\%\)=47,06%(2)
Giai hệ phương trình (1) và (2) ta có :
x=2,y=3,N=27g\mol
⇒CTHH:Al2O3.
Gọi tên : Nhôm oxit .
b)
PT 2Al(0H)3-to>Al2O3+3H2O
nAl2O3=0,05mol
=> nAl(OH)3 =0,1mol
mà H = 80% nên nAl(OH)3=0,125mol
=> mAl(OH)3 cần dùng = 0,125.78=9,75g

a) Đặt công thức oxit chung là MxOy
Theo đề bài ra , ta có : x + y = 5
Mặt khác : %O = 47,06% \(\Rightarrow\) %M = 52,94%
Mà : \(\dfrac{16y}{Mx}=\dfrac{47,06}{52,94}\)
Lập bảng giá trị :
| x | 1 | 2 | 3 | 4 |
| y | 4 | 3 | 2 | 1 |
| M | 72 | 27 | 12 |
4,5 |
Nghiệm phù hợp khi x = 2 ; M = 27 \(\Rightarrow\) M là Al
Vậy công thức oxit là Al2O3
b)
2Al(OH)3 \(\rightarrow\) Al2O3 + 3H2O ( 1 )
a---------------\(\dfrac{a}{2}\)
Ta có : \(n_{Al_2O_3}=\dfrac{m}{M}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
Từ ( 1 ) \(\Rightarrow n_{Al\left(OH\right)_3}=0,1\left(mol\right)\)
Vì H = 80% nên \(n_{Al\left(OH\right)_3}\) cần dùng là :
\(n_{Al\left(OH\right)_3}=\dfrac{0,1\cdot100}{80}=0,125\left(mol\right)\)
\(\Rightarrow m_{Al\left(OH\right)_3}=0,125\cdot78=9,75\left(g\right)\)
Vậy cần 9,75 gam Al(OH)3
LÀM LẠI CÂU B QUÊN CÂN BẰNG PTHH:
PT 2Al(0H)3->Al2O3+3H2O
nAl2O3=0,05mol
=> nAl(OH)3 =0,1mol
mà H = 80% nên nAl(OH)3=0,125mol
=> mAl(OH)3 cần dùng = 0,125.78=9,75g
Vậy..........................

a) Câu hỏi của Trần Thị Thùy Trang - Hóa học lớp 8 | Học trực tuyến
b) Ta có: Hiệu suất 80% thì tạo thành 5,1g Al2O3
.....Vậy: Hiệu suất 100% thì tạo thành m (g) Al2O3
=> m = \(\dfrac{100\times5,1}{80}=6,375\left(g\right)\)
=> nAl2O3 = \(\dfrac{6,375}{102}=0,0625\) mol
Pt: 2Al(OH)3 --to--> Al2O3 + 3H2O
....0,125 mol<-------0,0625 mol
mAl(OH)3 = 0,125 . 78 = 9,75 (g)
Vậy .........................

Câu hỏi của Trần Thị Thùy Trang - Hóa học lớp 8 | Học trực tuyến

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

Gọi công thức 2 oxit là A 2 Ox và A 2 Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
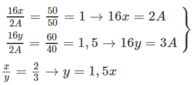
Chỉ có các cặp x, y sau có thể chấp nhận :
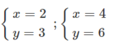
- Nếu chọn x = 2 → ta có 32 = 2A → A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 → ta có 64 = 2A → A = 32 → A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : S O 2 và S O 2

Ta có \(\frac{m_{O_2}}{m_A}.100\%=47,06\%\)(1)
Lại có : \(\frac{m_{Al}}{m_A}.100\%=52,94\%\)(2)
Từ (1) và (2) \(\Rightarrow\frac{m_{O_2}}{m_{Al}}=0,89\)
\(\Rightarrow\frac{n_{O_2}.M_{O_2}}{M_{Al}.n_{Al}}=0,89\)
\(\Rightarrow\frac{n_{O_2}}{n_{Al}}=0,75=\frac{3}{4}\)
CTHH của A là Al3O4

Gọi CTTQ của oxit là RxOy
Moxit=Rx+16y=232
=>16y/(Rx+16y)=1-0,7241
=>y=4
=>Rx=232-64=168
Chọn các giá trị nguyên của x thấy x=3 tm=>R=56 Fe
Đặt công thức oxit là RaOb
Theo đề ra, ta có: a + b = 5 (1)
Mặt khác: %mO = \(\frac{16b}{Ra+16b}\times100\%=47,06\%\) (2)
Giải hệ (1), (2) ta được \(\left\{\begin{matrix}a=2\\b=3\\R=27\left(\frac{g}{mol}\right)\end{matrix}\right.\)
=> CTHH của oxit là Al2O3
Gọi tên: Nhôm Oxit
cảm ơn nhiều!!!!!!!!!!!!!