Bài 1: Hãy xây dựng công thức các hợp chất sau:
a. Hợp chất A biết: thành phần % về khối lượng các nguyên tố là 40% Cu, 20% S và 40% O trong phân tử hợp chất có 1 nguyên tử S
b. Hợp chất B ( chất khí) biết tỉ lệ về khối lượng các nguyên tố tạo thành : mC : mH = 6 : 1, 1 lít khí B ( đktc ) nặng 1,52g.
c. Hợp chất C, biết tỉ lệ về khối lượng các nguyên tố là mCa : mN : mO = 10 : 7 : 24 và 0,2 mol hợp chất C nặng 32,8g.
d. Hợp chất D biết: 0,2 mol hợp chất D có chứa: 9,2g Na; 2,4g C và 9,6g O.
Bài 2: Đốt cháy 2,7g Al trong không khí thu đc 2,65g Al2O. Tính khối lượng các chất rắn còn lại sau phản ứng
Bài 3: Cho 6,4g Cu phản ứng hoàn toàn vs 3,36 lít O2 thu đc CuO.
a. Tính khối lượng CuO thu đc sau phản ứng
b. Tính khối lượng chất dư sau phản ứng
Mọi người giúp e ạ!!

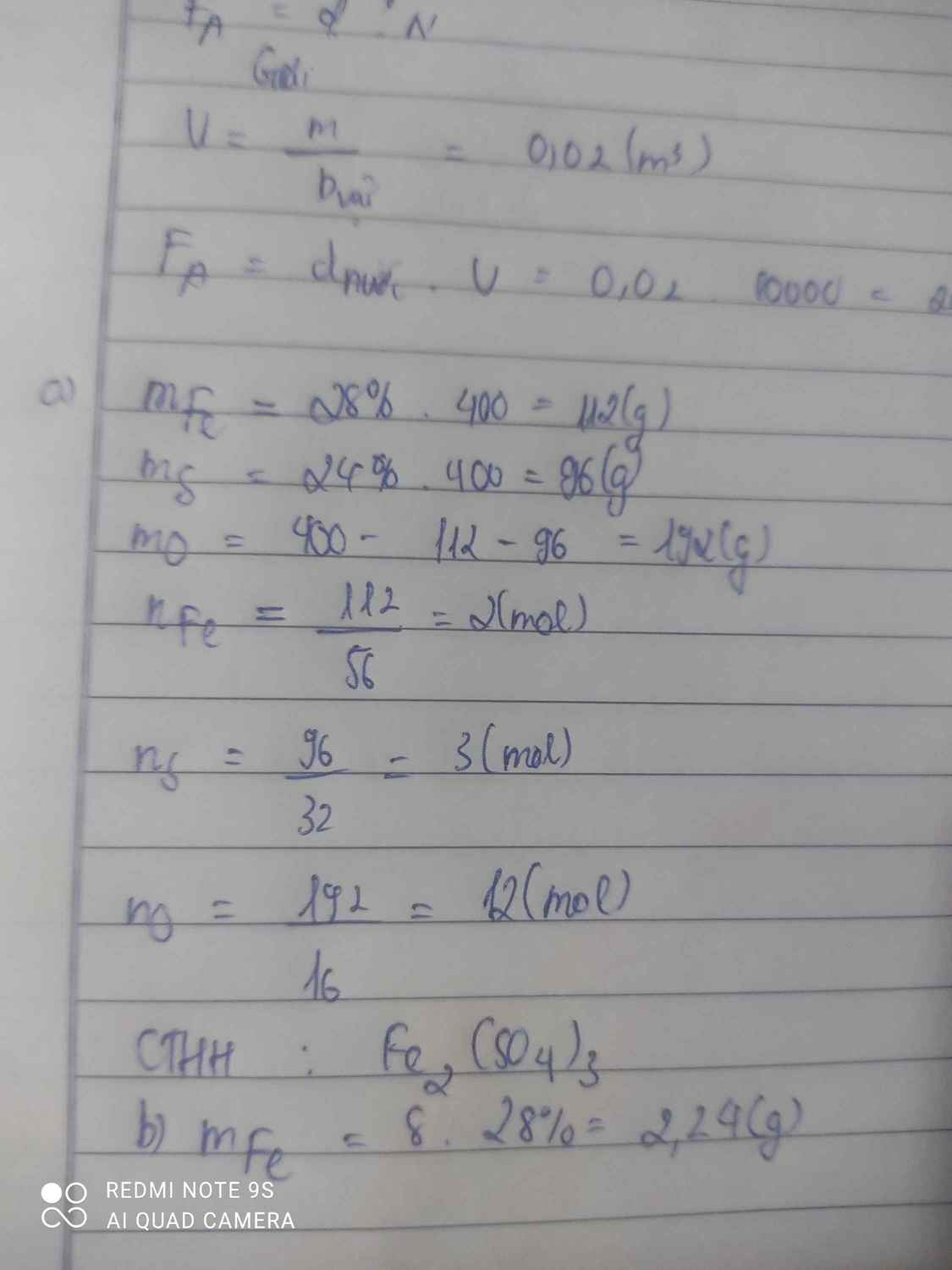

Bài 3: Giải:
Ta có:
\(n_{Cu}=\frac{6,4}{64}=0,1\left(mol\right);\\ n_{O_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Cu + O2 -> 2CuO
a) Theo PTHH và đề bài, ta có:
\(\frac{0,1}{2}=0,05< \frac{0,15}{1}=0,15\)
=> Cu hết, O2 dư nên tinh theo nCu
Theo PTHH và đề bài, ta có:
\(n_{CuO}=n_{Cu}=0,1\left(mol\right)\)
Khối lượng CuO thu được sau phản ứng:
\(m_{CuO}=0,1.80=8\left(g\right)\)
b) Theo PTHH và đề bài, ta có:
\(n_{O_2\left(phảnứng\right)}=\frac{n_{Cu}}{2}=\frac{0,1}{2}=0,05\left(mol\right)\)
=> \(n_{O_2\left(dư\right)}=0,15-0,05=0,1\left(mol\right)\)
Khối lượng O2 dư:
\(m_{O_2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
Bài 2:
PTHH: 4Al+3O2->2Al2O3
mol 4----3------2
nAl=\(\frac{2,7}{27}\)=0.1 mol ; nAl2O3=\(\frac{2,65}{102}\)≈0.026 mol
Ta có: nAl>2.nAl2O3
⇒Al dư
nAldư=nAlbanđau-nAlpư=0,1-2.0,026=0,048 mol
⇒⇒mAldư=0,048.27=1,296 g
Khối lượng các chất rắn còn lại sau phản ứng là:
mAldư+mAl2O3=1,296+2,65=3,946g