Cho 7,1g Al tác dụng vừa đủ với V ml dd H2SO4 loãng 0,05M; tạo ra khí H2 và Al2(SO4)3
a. Viết PTHH b. Tính V. c. Tính V H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

m dd A = 4 . 79,3 = 317,2g
Qui đổi hỗn hợp FeO, Fe2O3, Fe3O4về Fe3O4 có số mol là a
Ta có 232a + (a . 4 . 1,5 . 98) : 0,2 = 317,2
=> a = 0,1 mol
Dd ban đầu
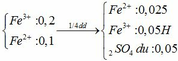
Phần 1:
8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + K2SO4
0,05 0,025
=> FeSO4 phản ứng hết
=> nKMnO4 = 0,005mol
=> V1= 0,1 lít = 100ml
Phần 2:
2Fe2+ + Br2 → 2Fe3+ + 2Br-
0,025 0,0125
=> V2 = 0,25 lít = 250ml
Phần 3:
2Fe3+ + 2I- → 2Fe2+ + I2
0,05 0,05
=> V3 = 1 lít = 1000ml
Phần 4:
Fe2+ + CO32- → FeCO3↓
0,025 0,025 0,025
2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3 + 3CO2
0,05 0,075 0,05 0,075
2H+ + CO32- →CO2 + H2O
0,1 0,05 0,05
=> nCO2 = 0,125
=> V4 = 2,8 lít
m kết tủa = mFeCO3 + mFe(OH)3 = 8,25g

--Nếu lấy 10ml dd H2SO4 trung hòa 30ml NaOH thì vừa hết
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
0,01a -> 0,02a
Mà 0,02a = 0,03b <=> 2a = 3b
--Nếu lấy 20ml H2SO4 tác dụng với 2,5g CaCO3 thì axit dư và lượng dư này tác dụng đủ với 10g dd NaOH
Ta có:
CaCO3 + H2SO4 -> CaSO4 + CO2 + H2O
0,025 -> 0,025
nH2SO4 dư = 0,02a - 0,025
Mà nH2SO4 dư tác dụng vừa hết với 10g dd NaOH thì
2NaOH + H2SO4 -> Na2SO4 + 2H2O
0,01b <-> 0,02a - 0,025
nNaOH = 2nH2SO4 => 0,04a - 0,05 = 0,01b <=> 4a - 5 = b
<=> 4a - b = 5
=> a = 1,5, b = 1
Vậy CM H2SO4 là 1,5M
CM NaOH là 1M
n H+ = 2n h2so4 + nHCl= 2*0,02y+ 0,005=0,04y+ 0,005 mol
n OH- =n Naoh= 0,03x
=> 0,03x=0,04y+0,005<=> 0,03x-0,04y=0,005(2)
tư(1) và (2) có hẹ pt, giải he ta đuọc x=1,1M, y=0,7M

a, Xác định tên kim loại
b, Tính V
c, Tính m
Giúp mk nhé

Đổi: \(200ml=0,2l\)
\(n_{NaOH}=C_{M_{NaOH}}\cdot V_{dd_{NaOH}}=2\cdot0,2=0,4mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+4H_2O\)
\(0,4----0,2---\left(mol\right)\)
Theo phương trình: \(n_{NaOH}=2n_{H_2SO_4}=0,4mol\Rightarrow n_{H_2SO_4}=0,2mol\)
\(V_{dd_{H_2SO_4}}=\dfrac{n_{H_2SO_4}}{C_{M_{H_2SO_4}}}=\dfrac{0,2}{1}=0,2l=200ml\)

\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)

\(a,\) Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=11(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Al_2(SO_4)_3+6NaOH\to 2Al(OH)_3\downarrow+3Na_2SO_4\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{Al(OH)_3}=x;n_{Fe(OH)_2}=y\\ \Rightarrow 78x+90y=24,6(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,1(mol) \end{cases} \Rightarrow \begin{cases} m_{Al}=0,2.27=5,4(g)\\ m_{Fe}=11-5,4=5,6(g) \end{cases}\)
\(b,\Sigma n_{H_2SO_4}=1,5x+y=0,4(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,4}{0,2}=2(l)\\ c,\Sigma n_{NaOH}=3x+2y=0,8(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,8.40}{10\%}=320(g)\\ d,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ Fe(OH)_2\xrightarrow{t^o}FeO+H_2O\\ \Rightarrow n_{Al_2O_3}=0,1(mol);n_{FeO}=0,1(mol)\\ \Rightarrow m_{\text{chất rắn}}=0,1.102+0,1.72=17,4(g)\)

\(3Ag+4HNO_3\rightarrow3AgNO_3+NO+2H_2O\)
\(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(NO\) là sản phẩm khử duy nhất.
\(\Rightarrow n_{NO}=\dfrac{0,448}{22,4}=0,02mol\)
Ta có: \(\left\{{}\begin{matrix}27n_{Al}+108n_{Ag}=3,51g\\BTe:3n_{Al}+n_{Ag}=3n_{NO}=0,06\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,01mol\\n_{Ag}=0,03mol\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,01\cdot27}{3,51}\cdot100\%=7,7\%\)
\(\%m_{Ag}=100\%-7,7\%=92,3\%\)
\(\text{Em sửa 7,1 thành 8,1g nha}\\ a/ 2Al+3H_2SO_4 \rightarrow Al_2(SO_4)_3+3H_2\\ b/ \\ n_{Al}=0,3mol\\ n_{H_2SO_4}=\frac{3}{2}n_{Al}=\frac{3}{2}.0,3=0,45mol V_{H_2SO_4}=\frac{0,45}{0,05}=9M\\ c/ \\ V_{H_2}=0,45.22,4=10,08l\)
a)\(n_{Al}=\dfrac{7,1}{27}\approx0,26\left(mol\right)\)
PTHH:\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,26----->0,39-------->0,13------->0,39 (mol)
b)\(V_{H_2SO_4}=0,39\cdot22,4=8,736\left(l\right)\)
c)\(V_{H_2}=0,39\cdot22,4=8,736\left(l\right)\)